
Химия

Современная химия очень разнообразна как по объектам изучения, так и по методам исследований. Сейчас известно около полутора десятков миллионов химических соединений, и каждое из них может вступать во множество реакций. В зависимости от характера изучаемых объектов и целей исследований химия разделена на большие разделы: органическая химия, неорганическая химия, химия высокомолекулярных соединений, физическая и аналитическая химия, химическая технология.
Деление на два основных раздела — органическую и неорганическую химию (химию живой и неживой материи) — сложилось в прошлом веке. Органическая химия — это химия соединений углерода, в которых атомы углерода объединены в длинные цепи и циклы. Значение таких соединений огромно, поскольку вся жизнь на Земле связана с их возникновением и превращениями. В состав органических соединений кроме углерода входят водород, азот, кислород, фосфор.
Все остальные химические вещества, в состав которых могут входить любые из более ста химических элементов, изучает неорганическая химия. В ее компетенции находятся соединения, образующие атмосферу Земли, ее поверхность и недра, Мировой океан, — все, что называют неживой материей, которая не способна к воспроизводству, в отличие от живой. Различия между живым и неживым миром обусловлены химическими свойствами веществ, их образующих.
При всем многообразии химических соединений и реакций, в которые они вступают, а также целей, которые ставят перед собой исследователи, — будь то открытие новых соединений или производство давно известных веществ — можно выделить основополагающие принципы и законы химии. В данной главе и будут как раз рассмотрены такие общие закономерности.
Это прежде всего основы атомно-молекулярного учения, являющегося итогом целого периода изучения химии — с древних времен до конца XIX в. Наблюдая за различными процессами превращения веществ, ученые пришли к выводу, что все вещества состоят из мельчайших частиц — атомов и молекул, важнейшей характеристикой которых является масса. Тогда же были сформулированы и основные законы химии; в дальнейшем они уточнялись, получали объяснение с точки зрения новейших открытий, но тем не менее не потеряли своего значения для химии в целом. Это законы сохранения массы, постоянства состава, кратных и объемных отношений. Гипотеза Авогадро, превратившаяся в один из основных законов физики и химии, следствия из нее, а также сформулированный чуть позже универсальный газовый закон открыли способ установления стандартной шкалы атомных масс, которыми пользуются до настоящего времени. Тем самым была заложена количественная основа современной химии.
|
Взаимодействие галактик, звездных скоплений и планет осуществляется в астрономическом масштабе, где оперируют расстояниями от миллионов световых лет до миллионов километров. Это сфера астрономии и астрофизики. Макроскопический масштаб - от десятков тысяч километров до миллиметров - соответствует миру человека и окружающих его тел. Специфику явлений на этом уровне изучают биология, геология, география, классическая физика. |
К середине XIX столетия химиками открыто более пятидесяти химических элементов, определены их атомные массы, изучены свойства образуемых ими соединений. Все это послужило основой для установления главного закона химии — Периодического закона Д. И. Менделеева. Гениальность ученого заключалась в том, что закономерность изменения свойств химических элементов при увеличении массы атомов была определена еще до появления какого-либо объяснения этого явления. С течением времени значение Периодического закона нисколько не уменьшилось. Открытие новых элементов и проведение современных фундаментальных исследований только еще больше укрепило его. Периодическая таблица химических элементов, созданная на основе этого закона, — главный путеводитель при изучении химических свойств веществ.
Настоящая революция в химии произошла в начале XX в., когда были сформулированы основные положения квантовой механики и определено строение атома. Это явилось истинным ключом к пониманию как сути Периодического закона, так и строения вещества. Кроме того, стала ясна теснейшая связь химии с физикой. Ведь различие между естественными науками состоит главным образом в уровне (масштабе) изучаемых явлений.
Современные теории строения вещества позволяют объяснить и предсказать свойства молекул, а также реальных веществ, представляющих собой совокупность большого числа частиц. Уровень современной экспериментальной техники обеспечивает изучение превращений отдельных молекул. В последнее время появилась возможность методом компьютерного моделирования на основе расчетов квантовой механики определять структуру химических соединений, механизмы и кинетику химических реакций, трудно поддающихся экспериментальному изучению. Традиционная химия изучает превращения (реакции), происходящие в макроскопическом масштабе, — в лаборатории или в окружающем мире, а затем интерпретирует их на атомно-молекулярном уровне.
|
В последние пятьдесят лет усилился интерес к исследованию механизмов организации материи на мезоскопическом уровне - от нескольких десятков нанометров до сотен микрометров (1 нм = 10-9 м). Это привело к развитию таких наук, как микробиология, коллоидная химия, химия и физика высокомолекулярных соединений. Микроскопический уровень - от сотых долей до десятков нанометров - относится к внутренней структуре макроскопических тел, определяемой атомно-молекулярными взаимодействиями. Исследованиями в этой области занимаются химики и специалисты по квантовой механике. Внутренняя структура протонов и нейтронов, из которых состоит ядро атома, их взаимодействия и взаимодействия других элементарных частиц, происходящие на расстояниях менее 10-15 м, образуют фундаментальный уровень организации материи. Изучение процессов на этом уровне - сфера квантовой теории поля и физики элементарных частиц. |
Главный вопрос, который нужно решить химику, — это пойдет ли химическая реакция, а если пойдет, то каков будет выход получившегося вещества и как надо изменить условия проведения реакции для того, чтобы выход продуктов был оптимальным, а скорость процесса приемлемой. Закономерности протекания химических реакций изучает физическая химия, которая исследует вещества, состоящие из большого числа частиц, с помощью физических методов и на базе физических законов, таких, как, например, законы термодинамики и кинетики. Так, химическая термодинамика позволяет определить вероятность протекания той или иной реакции. Рассчитанные на основе термодинамических характеристик константы химических равновесий определяют полноту прохождения реакций, т. е. насколько полно протекает реакция в созданных условиях.
Основные термодинамические характеристики веществ — энтальпия образования, энтропия, теплоемкость — сведены в таблицы. И даже оценочный расчет, произведенный с их использованием, очень полезен для того, чтобы априори, до эксперимента, предсказать результат. Однако даже термодинамически вероятный процесс может не пойти. Причину этого следует искать в кинетике — скорости протекания реакций.
Изучение скоростей реакций очень важно как для определения условий проведения химических процессов, так и для установления механизмов реакций. Одним из способов изменения скорости реакции является использование катализаторов. Поиск новых катализаторов, исследование механизма их действия и внедрение их в практику — одна из приоритетных задач современной химии. Катализ играет важную роль и в биохимических процессах, где в роли катализаторов выступают ферменты — сложные белковые соединения.
Знание общих законов необходимо исследователю, работающему в любой отрасли химической науки, — будь то изучение процессов, протекающих в недрах Земли, при производстве полимерных материалов или в организме человека.
Атомы и молекулы являются основными понятиями химии. Открытие элементарных частиц и развитие квантовой механики в начале XX в. окончательно сформировали современное представление об атомах и молекулах.
|
Представления о том, что окружающие нас тела состоят из мельчайших частиц, возникли очень давно. В V - 1V вв. до н. э. Левкипп и Демокрит писали о дискретности вещества. Р. Бойль в XVII в. ввел понятие об атомах и молекулах. В 1741 г. М. В. Ломоносов сформулировал основные понятия атомно-молекулярного учения: все вещества состоят из «корпускул» (молекул); молекулы состоят из «элементов» (атомов); частицы (молекулы и атомы) находятся в непрерывном движении, усиливающемся при нагревании вещества; молекулы простых веществ состоят из одинаковых «элементов», молекулы сложных веществ - из разных «элементов» (атомов). Развитие атомно-молекулярного учения продолжили многие выдающиеся химики - Д. Дальтон, С. Канниццаро и другие. |
В 1860 г. на Международном съезде химиков в городе Карлсруэ было принято следующее определение понятий «молекула» и «атом».
Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Размеры атомов и молекул чрезвычайно малы. Масса атома углерода, например, равна 1,99 х 10-23 г, а объем его составляет порядка 3 x 10-16 см3. Массы атомов обычно измеряют в относительных величинах. Относительной атомной массой атома называют отношение его абсолютной массы к массе 1/12 части массы атома углерода. Современные методы исследования, такие, как электроно- и нейтронография, электронная микроскопия, позволяющие увидеть отдельные молекулы и атомы, подтвердили правильность гипотез гениальных ученых древности. Между атомами в молекулах образуются внутримолекулярные связи, а молекулы в химических веществах удерживаются межмолекулярными связями.
В состав молекулы может входить несколько атомов. Так, молекулы благородных газов одноатомны, молекулы водорода и азота двухатомны, воды трехатомны и т. д. Молекулы наиболее сложных веществ — высших белков и нуклеиновых кислот — построены из сотен тысяч атомов. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом.
Химические свойства молекулы определяются ее качественным составом (т. е. из атомов какого элемента она состоит) и строением (последовательности соединения атомов друг с другом). Так, молекулы этилового спирта и диметилового эфира имеют одинаковый качественный состав — С2НбО, однако по строению различаются: спирт СН3 — СН2 — ОН, эфир СН3 — О — СН3.
Молекулы, соединяясь вместе, образуют вещества. С веществами мы имеем дело в повседневной жизни. В зависимости от характера взаимодействия частиц, образующих вещество, оно может находиться в разных агрегатных состояниях: жидком, твердом и газообразном. То, в каком состоянии находится вещество, зависит от внешних условий и, конечно, от природы самого вещества. При низкой температуре частицы вещества прочно связаны между собой и образуют правильную геометрическую структуру, имеют свою форму и объем, — это твердое состояние. При повышении температуры частицы могут смещаться относительно друг друга, но все еще находятся в контакте, имеют свой определенный объем, но не имеют формы (принимают форму сосуда, в котором находятся). Такое состояние вещества называется жидким. При дальнейшем повышении температуры частицы становятся практически несвязанными друг с другом — вещество переходит в газообразное состояние. Газы не имеют ни собственного объема, ни формы. Они способны расширяться и занимать весь объем сосуда, в котором находятся.
| Если бросить в воду Н2О кусочек натрия, то тут же начнет выделяться газ - это водород Н2, а жидкость превратится из воды в едкое вещество - щелочь. При этом выделится так много тепла, что водород может загореться и даже произойдет взрыв. Никогда не бросайте натрий в воду! | ||
|
а |
б |
в |
| Три фазовых состояния вещества: а - газовая фаза: б - жидкость: в - кристалл. | ||
При сравнительно небольшом числе химических элементов количество различных веществ очень велико. Частицы, которые образуют вещества, необязательно являются молекулами. Это могут быть атомы или ионы.
Ионами называются частицы, состоящие из одного или нескольких атомов, но, в отличие от электронейтральных молекул, имеют заряд положительный (катионы) или отрицательный (анионы).
Процессы, в результате которых одни химические вещества превращаются в другие, называются химическими реакциями. В результате химических реакций происходит разрушение одних связей между атомами в молекуле и образование других. Продукты реакций отличаются по химическим свойствам от исходных веществ.
Никакими физическими способами нельзя из образовавшихся веществ вновь получить исходные. Этим химические процессы отличаются от физических, например от замерзания воды.
На разных языках один и тот же химический элемент может называться по-разному. Чтобы понимать друг друга, химики создали язык символов и формул.
В настоящее время насчитывается около 110 химических элементов. Некоторые из элементов были известны еще с древних времен, и происхождение их неизвестно — медь, серебро, железо, ртуть и т. д. Серебро алхимики называли Луной, медь — Венерой, железо — Марсом. Современные названия элементов образовались от имен мифологических персонажей (тантал, прометий), от географических названий (америций, германий, скандий), от названия планет и минералов (теллур, бериллий, алюминий), от фамилий великих ученых (кюрий, эйнштейний). Символы химических элементов были введены в науку шведским химиком Йенсом Берцелиусом в 1813 г. Символами химических элементов обычно являются 1 - 2 начальные буквы их латинского названия. Названия и символы химических элементов можно найти в Периодической таблице элементов.
|
Название элементу азоту дал французский химик Лавуазье. Слово «азот» происходит от греческого «а-зоос», что означает безжизненный. Однако слово «азот» имело и совсем другой смысл, отвечающий больше «жизненной силе», а по библейской мифологии - «начало и конец всего сущего». Такое неудачное название привело к тому, что появилось другое название этого элемента: «нитрогениум» - «рождающий селитру» (KNO3). От этого названия произошел и символ азота «N». Поэтому и соединения азота имеют разные названия: HNO3 - азотная кислота, а ее соли - нитраты.
Обозначения химических элементов Дальтоном. |
СЛОЖНОЕ ХИМИЧЕСКОЕ СОЕДИНЕНИЕ записывается с помощью символов атомов элементов, образующих данную молекулу, а количество атомов в молекуле указывается в правом нижнем индексе символа. Например, молекула аммиака состоит из атома азота N и трех атомов водорода Н и записывается как NH3 — это химическая формула вещества. Обозначение химических веществ с помощью формул позволило записывать кратко и химические реакции — в виде уравнений химических реакций. Вместо слов «при взаимодействии цинка с хлороводородной кислотой образуются хлорид цинка и водород» пишут:
Zn + 2НСL = ZnCL2
+ Н2.
Исходные Продукты
вещества реакции
Иногда, чаще в органической химии, в уравнениях ставят знак « → », который указывает направление химической реакции. В таком случае можно говорить лишь о схеме реакции. Схема становится уравнением химической реакции после подбора стехиометрических коэффициентов. И тогда ставится знак « = » или знак « ↔ » для обратимых реакций. Для обозначения агрегатного состояния продуктов реакций, протекающих в растворах, используют знак « ↑ », если выделяются газообразные продукты реакции, и знак « ↓ », если образуются нерастворимые продукты. Уравнение химической реакции показывает и количественные соотношения реагирующих веществ. Эту информацию несут стехиометрические коэффициенты — цифры перед формулами соединений. Так, в приведенном примере из одной молекулы Zn и двух молекул НСL образуются 1 молекула ZnCL2 и 1 молекула Н2.
| Желтая и красная кровяные соли
получили свои названия от способа получения. Их получали из животных
отбросов, в том числе и крови, собираемых на бойнях, путем
нагревания в присутствии карбоната калия и железных опилок. Из
раствора, который образовывался при обработке реакционной массы
водой, кристаллизовалась соль K4[Fe(CN)6].
Это вещество называли желтой кровяной солью, так как оно имеет
желтый цвет, в отличие от красной кровяной соли К3[Fе(СN)6].
Современное название этих солей - гексацианоферрат (II) калия и
гексацианоферрат (III) калия. Они используются для аналитического
определения ионов железа благодаря синей окраске осадка KFe[Fe(CN)6],
названной «турнбулевой синью» в конце XVIII в. в честь Турнбуля -
владельца завода по производству красок для тканей. Современная номенклатура была разработана в 1956 г. Номенклатурной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). |
Так как массы молекул очень малы, для обозначения количества вещества используется величина моль.
Моль — это единица количества вещества, содержащая столько же структурных единиц (молекул, атомов, ионов), сколько атомов содержит 12 г углерода. Моль любого вещества содержит 6,02 х 1023 частиц.
Число NA = 6,02 х 1023 моль-1 является фундаментальной константой физики и химии и называется постоянной Авогадро. Значение молярной массы численно совпадает с относительной молекулярной массой.
Моль любого вещества содержит одинаковое число частиц, например молекул, поэтому в реакцию вступают количества вещества, пропорциональные стехиометрическим коэффициентам химического уравнения.
Моль — основная количественная величина в химии.
Названия сложных веществ еще более разнообразны.
Многие тривиальные названия сложных веществ возникли случайно очень давно, причем одно и то же вещество могло иметь несколько наименований. Так, серную кислоту H2SO4 называли «купоросной кислотой», «купоросным спиртом», «серным маслом» (от названия минерала — медного купороса CUSO4 х х 5Н2О, из которого в то время получали H2SO4).
Еще в XVIII - XIX вв. ученые открыли общие законы, которыми определяются отношения между количествами веществ в химических реакциях. Их называют основными законами химии.
|
До 1961 г, атомная единица массы у физиков и химиков отличалась. Хотя отличие и было около 0,03%, однако это вызывало определенные неудобства. Такое различие возникло из-за того, что за единицу физики принимали 1/16 массы изотопа кислорода 16О, а химики 1/16 массы природного кислорода, который является смесью трех изотопов. Теперь принята единая система измерения, и за единицу принята 1/12 массы изотопа углерода 12С.
1 - печь;
3 - реторта: |
ЗАКОН СОХРАНЕНИЯ МАССЫ И ЭНЕРГИИ был сформулирован великим русским ученым Михаилом Васильевичем Ломоносовым в середине XVIII в.: «Ничто не возникает из ничего и ничто не исчезает бесследно». Ломоносов на основании проведенного им опыта по взаимодействию ртути с воздухом в запаянном сосуде показал, что масса сосуда не изменилась после реакции. Независимо от русского ученого в 1789 г. французский химик Антуан Лоран Лавуазье поставил ряд тщательно спланированных опытов по окислению металлов и восстановлению их оксидов углем. После этого закон сохранения массы окончательно утвердился в химии: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Закон сохранения массы имел огромное значение для становления атомно-молекулярной теории. Этот закон является частным случаем всеобщего закона сохранения материи (закона сохранения массы и энергии). Масса m и энергия Е связаны между собой соотношением, которое называют уравнением Эйнштейна:
Е = mc2,
где с — скорость света, равная 2,998 х 108 м х с-1. Если в процессе выделяется большое количество энергии, то соответственно уменьшается масса. Такие изменения характерны для ядерных реакций. Химические реакции обычно сопровождаются энергетическими эффектами, соответствующими чрезвычайно малому изменению массы. Так, при диссоциации молекулы хлора на атомы (CL2 = 2СL) необходима энергия 242,8 кДж/моль. Массовый эквивалент этой энергии соответствует 2,7 х 10-9 г/моль, т. е. энергия диссоциации молекулы хлора эквивалентна лишь 0,000005 части массы электрона. Вот почему в химических реакциях можно использовать два независимых закона сохранения — массы и энергии.
ЗАКОН ПОСТОЯНСТВА СОСТАВА был сформулирован французским химиком Ж. Прустом в 1811 г., после того, как стало возможно достаточно точно определять массовые соотношения элементов в соединениях. Независимо от способа получения химического соединения его состав остается неизменным. Каким бы способом ни получали, например, диоксид углерода СО2 — разложением ли карбоната кальция (СаСО3 = СаО + СО2), взаимодействием ли карбоната натрия с кислотой (Na2СО3 + 2НСL = 2NaCL + СО2 + 2Н2О), при горении ли метана (СН4 + 2O2 = СО2 + 2Н2О), — состав его будет один и тот же, потому что химические связи в молекулах возникают вполне определенным образом, в соответствии со строением атомов. Все вещества, состоящие из отдельных молекул (главным образом жидкости и газы), подчиняются этому закону.
|
Ломоносов М. В. и А. Лавуазье заложили основы новой химии, доказав, что масса является фундаментальным свойством. Д. Дальтон превратил философское понятие об атомах в реальность, продемонстрировав, что атомистическая теория способна объяснять экспериментальные факты. В результате появились закон эквивалентов и закон кратных отношений. Однако построение согласованной таблицы атомных масс оказалось делом не из легких. Окончательно все встало на свои места лишь в 1860 г., когда С. Канниццаро обратился к гипотезе Авогадро, которая стала одним из основных законов физики и химии, следствия из нее открыли способ установления стандартной шкалы атомных масс, которыми пользуются в настоящее время. |
Однако существует большое число твердых веществ, состав которых зависит от способа получения и может изменяться в некоторых пределах. Например, в оксиде железа (II) FeO мольное соотношение Fe : О может изменяться от 1 : 1,05 до 1 : 1,2. Это связано с тем, что в твердых кристаллических телах практически невозможно выделить отдельные молекулы. В таких случаях формула показывает лишь идеальное соотношение между общим количеством атомов в кристалле. В реальности из-за теплового движения атомов и других флуктуаций (случайных отклонений от средних значений) соотношение может быть несколько другим. Это общее правило для всех твердых тел. Но величина отклонения от идеального состава очень мала. Изложенное выше отнюдь не ставит под сомнение правильность закона постоянства состава для молекулярных веществ.
Еще до открытия закона постоянства состава в конце XVIII в. немецкий химик И. Рихтер сформулировал закон эквивалентных соотношений, который теперь звучит так: вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам, или массы реагирующих друг с другом веществ пропорциональны их эквивалентным массам. Во времена открытия этого закона эквивалентные массы называли соединительными весами.
Например, известно, что при взаимодействии водорода с кислородом с образованием Н2О массы вступивших в реакцию кислорода и водорода относятся как 8 : 1, а при взаимодействии кислорода с углеродом с образованием СО2 массы кислорода и углерода относятся как 8 : 3. Закон эквивалентов утверждает, что в метане СН4 соотношение масс углерода и водорода равно 3 : 1. Эквивалентная масса каждого элемента может быть определена как масса этого элемента, соединяющаяся с 1 г водорода или замещающая его в химических реакциях. На основании этого закона И. Рихтер определил соединительные веса многих элементов. Оказалось, что один и тот же элемент может иметь разные соединительные веса. Например, эквивалентная масса азота в NO равна 7, в NO2 — 3,5, в N2O — 14, а в аммиаке NH3 — 4,67. Это действительно так, химический эквивалент не является постоянной величиной, он зависит от валентности. Эквивалентная масса элемента в соединении равна частному от деления атомной массы на его валентность в этом соединении.
|
Прибор для
определения молекулярных масс легкокипящих жидкостей: |
Открытый английским физиком и химиком Д. Дальтоном закон кратных отношений стал дальнейшим шагом к пониманию атомистической теории, а также количественных соотношений в химии: если один элемент образует несколько соединений с другим элементом, то его соединительные веса находятся в простых целочисленных отношениях друг к другу. В нашем примере это значит, что для азота в его оксидах эквивалентные массы относятся друг к другу как небольшие целые числа. Действительно, 3,5 : 7 : 14 = 1 : 2 : 4. Дальтон объяснил это тем, что, согласно атомистической теории, атомы соединяются друг с другом небольшими целочисленными порциями, и был абсолютно прав. Однако составленная Дальтоном таблица атомных масс была несовершенна, потому что он считал молекулы простых веществ одноатомными.
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ были открыты в конце XVIII — начале XIX в. после определения зависимостей между такими важнейшими параметрами, как давление Р, температура Т и объем V. Еще в XVII в. Р. Бойль и Э. Мариотт, изучая свойства разреженного воздуха, установили связь между его объемом и давлением.
При постоянной температуре для заданного количества газа давление обратно пропорционально объему (закон Бойля — Мариотта):
Р1V1 = P2V2 или PV = const
при Т = const.
Спустя почти сто лет после открытия закона Бойля — Мариотта французские ученые
Ж.-Л. Гей-Люссак и Ж. Шарль открыли законы, определяющие зависимость объема газа
от температуры.
При постоянном давлении для заданного количества газа объем прямо пропорционален абсолютной температуре (закон Гей-Люссака):
V1/T1 = V2/T2, или V/T =
const при Р = const.
При постоянном объеме для заданного количества газа давление прямо пропорционально абсолютной температуре (закон Шарля):
P1/T1 = Р2/Т2, или Р/Т =
const при V = const.
«ХИМИЧЕСКИЕ» ЗАКОНЫ ЗНАМЕНИТЫХ ФИЗИКОВ. Исследуя реакции газов, Ж.-Л. Гей-Люссак установил, что объемы газообразных веществ и продуктов их реакции относятся друг к другу как небольшие целые числа (закон объемных отношений). А. Авогадро сформулировал его так: в равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул. (Это закон Авогадро.)
|
Экспериментальные данные Гей-Люссака об объемах соединяющихся газов и их интерпретации Авогадро можно проиллюстрировать так:
|
Из закона Авогадро вытекают два важных следствия.
I. Один моль любого газа, содержащий 6,02 х 1023 молекул, при одинаковых условиях занимает один и тот же объем. При нормальных условиях — давлении 1,013 х 105 Па (1 атм) и температуре 273 К (0° С) — этот объем составляет 22,4 л и называется молярным объемом.
II. Массы равных объемов двух газов (при одинаковых давлении и температуре) относятся друг к другу как их молярные массы.
К концу XIX в. француз Б. Клапейрон установил, что для заданной массы газа соотношение PV/T есть величина постоянная, а Д. И. Менделеев вывел уравнение для одного моля газа. Объединив эти соотношения (для любого количества газа), получим уравнение состояния идеального газа, называемое уравнением Клапейрона — Менделеева:
PV = ʋRT,
где ʋR — универсальная газовая постоянная. Универсальная газовая постоянная — это отношение PV/Т для одного моля газа, которое в единицах системы СИ равно 8,314 Дж/ (моль К).
 |
 |
| Газ, выделяющийся в процессе реакции, двигает поршень - энергия химической реакции превращается в механическую работу. | |
Эти законы послужили основой для определения формул газообразных соединений и их молекулярных масс. Уравнение Клапейрона — Менделеева широко используется для расчета объемов газов, выделяющихся в результате химических реакций. Однако это уравнение строго выполняется лишь для идеальных газов — математической модели, согласно которой молекулы не имеют объема и их соударения абсолютно упругие.
ПЕРИОДИЧЕСКИЙ ЗАКОН ЭЛЕМЕНТОВ. После утверждения атомно-молекулярной теории важнейшим событием в химии стало открытие Д. И. Менделеевым периодического закона. Это открытие, сделанное в 1869 г. гениальным русским ученым, создало новую эпоху в химии. Опирающаяся на периодический закон классификация химических элементов, которую Менделеев выразил в форме периодической системы, сыграла очень важную роль в изучении свойств химических элементов и дальнейшем развитии учения о строении вещества.
|
В 1819 г. П. Дюлонг и А. Пти заметили, что молярные теплоемкости многих твердых простых веществ имеют значение, близкое к 25 Дж/(моль х К). Поэтому по удельной теплоемкости простого вещества (удельная теплоемкость - это количество тепла, необходимое для повышения температуры 1 г вещества на 1°, мольная - одного моля вещества) можно найти атомную массу. Например, удельная теплоемкость серебра 0,233 Дж/(град х г), тогда атомная масса будет равна 25 : 0,233 = 107 г/моль. Дело в том, что процесс поглощения тепла связан с числом атомов, а не с массой вещества. Однако в то время ученые не могли объяснить обнаруженный факт. Только после того, как Канниццаро предложил способ определения атомных масс легких элементов, метод Дюлонга и Пти стали применять для приблизительного определения атомных масс тяжелых элементов.
|
Расположив все элементы в порядке возрастания атомных весов, Менделеев обнаружил, что сходные в химическом отношении элементы встречаются через правильные интервалы и что, таким образом, в ряду элементов многие их свойства периодически повторяются. Эта закономерность получила свое выражение в периодическом законе, который Менделеев сформулировал так: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от атомных весов элементов».
В начале XX в. развитие физики привело к открытию строения атома. Для дальнейшего понимания структуры Периодической таблицы элементов основную роль сыграли открытия английского физика Г. Мозли. Он исследовал частоты рентгеновского излучения, испускаемого элементами при бомбардировке их электронным пучком. На основании этих исследований было установлено, что порядковый номер элемента в Периодической таблице соответствует заряду ядра атома. Основной характеристикой атома, лежащей в основе периодической зависимости, является заряд ядра. Современная формулировка периодического закона такова: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов.
При создании Периодической системы ученый руководствовался не только известными атомными массами элементов, но и их химическими свойствами. Такой подход к проблеме позволил, во-первых, уточнить атомные массы многих известных тогда элементов и, во-вторых, предсказать существование не открытых еще элементов и их свойства, например германия (экасилиций) и галлия (экабор).
|
Вещества, имеющие переменный состав, в честь французского химика Клода Бертолле назвали бертоллидами. Вещества, подчиняющиеся закону постоянства состава, иногда называют дальтонидами в честь английского химика Д. Дальтона, составившего первую в истории таблицу атомных масс. |
В начале XX в. развитие физики привело к открытию строения атома. Для дальнейшего понимания структуры Периодической таблицы элементов основную роль сыграли открытия английского физика Г. Мозли. Он исследовал частоты рентгеновского излучения, испускаемого элементами при бомбардировке их электронным пучком. На основании этих исследований было установлено, что порядковый номер элемента в Периодической таблице соответствует заряду ядра атома. Гениальное построение системы Менделеевым полностью подтвердилось; стали объяснимы перестановки элементов в таблице вопреки последовательности атомных масс (Со и Ni; I и Те). Основной характеристикой атома, лежащей в основе периодической зависимости, является заряд ядра. Современная формулировка периодического закона такова: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов.
Периодический закон — не только один из важнейших законов химии.
Его появление, по существу, завершило процесс классификации и систематизации
веществ, чем в основном занимались химики. Однако окончательно стала понятна
причина периодичности свойств элементов только после установления электронного
строения атома, что, в свою очередь, дало периодическому закону и Периодической
системе элементов новое, более глубокое освещение. Блестящее подтверждение этому
дали пророческие слова Менделеева: «Периодическому закону не грозит разрушение,
а обещаются только надстройка и развитие».
Строение атома есть ключ к пониманию строения молекул и механизмов химических реакций, иными словами, химических свойств веществ.
|
Первой моделью атома как частицы, содержащей электроны, была модель Томпсона. Согласно этой модели, масса и весь положительный заряд однородно распределен по всему атому, а электроны помещаются в нем, как «изюм в булочке». Опыты Резерфорда по рассеиванию α-частиц при бомбардировке или тонкой золотой фольги опровергли эту модель. Возникло представление о чрезвычайно плотном положительно заряженном ядре, окруженном электронами. Область атома, занятая электронами, по радиусу приблизительно в 100 000 раз больше радиуса ядра. В 1913 г. Нильс Бор выдвинул новую теорию строения атома водорода: электроны движутся вокруг ядра со строго определенной энергией и на определенном расстоянии от ядра. Переход электронов с более удаленных орбит на более близкие сопровождается выделением кванта света. Таким образом были объяснены спектры испускания атома водорода. Однако эта модель противоречила существующим тогда теориям и, кроме того, не могла объяснить спектры поглощения более тяжелых атомов. |
ПОНЯТИЕ «АТОМ» было введено еще до нашей эры. Естественно, модели строения атома менялись с развитием естествознания, и особенно физики. Современное представление об атоме сложилось в начале XX в., когда были открыты элементарные частицы — составные части атома, а также создана квантовая механика, позволившая адекватно описать свойства микромира.
Свойства элементарных частиц
| Частица | Символ* | Масса, а. е. м. | Масса, г | Заряд**, е- |
| Протон | 11p | 1,0073 | 1,67 x 10-24 | +1 |
| Нейтрон | 01n | 1,0087 | 1,67 х 10-24 | 0 |
| Электрон | e- | 0,00055 | 9,1 х 10-28 | -1 |
* Верхний индекс - массовое число, нижний - заряд.
** Элементарный заряд е- = 1,602 х 10-19 Кл.
Атом — химически неделимая нейтральная частица, состоящая из более мелких элементарных частиц — протонов, нейтронов и электронов. Основные свойства (заряд и масса) этих частиц приведены в таблице.
Протоны и нейтроны в атоме образуют положительно заряженное ядро, в котором, как видно из таблицы, сосредоточена практически вся масса атома. Положительный заряд ядра определяется числом протонов.
Электроны в атоме движутся вокруг ядра и занимают пространство, которое в несколько тысяч раз превышает размер самого ядра (диаметр ядра 10-12 см, а диаметр атома 10-8 см). Заряд ядра является главной характеристикой атома. Он определяет число его электронов. Химические же свойства атома зависят исключительно от его электронной структуры, в химических реакциях только электроны участвуют в образовании химической связи.
Химическим элементом называется вид атомов, характеризующийся определенной величиной положительного заряда ядра. Строение атома химического элемента, например углерода, записывают так: 12 6С. Верхний индекс (12) соответствует массовому числу атома (сумме протонов и нейтронов в ядре, численно равной его атомной массе), нижний индекс (6) — заряду ядра атома, т. е. количеству протонов в ядре и количеству электронов в атоме. Свойства ядер имеют большое значение при обсуждении радиоактивности и ядерного синтеза.
|
Форма и расположение (пространственная ориентация) S-, р- и d-opбиталей. |
ЭЛЕКТРОННОЕ СТРОЕНИЕ атома дает информацию об энергии электрона и вероятности нахождения его в каждой точке пространства вблизи ядра. Для описания поведения электрона в атоме надо сначала определить, что такое электрон с точки зрения современной квантовой механики.
Во-первых, важно знать, что такие микрочастицы, как электроны, обладают свойствами и частицы, и волны.
Во-вторых, невозможно одновременно точно найти положение (координату) и импульс электрона, как, впрочем, и других частиц (принцип неопределенности Гейзенберга).
В-третьих, энергия электромагнитного излучения (в том числе и электронов) меняется не непрерывно, а порциями — квантами.
Таким образом, в соответствии с законами квантовой механики, движение электрона в атоме нельзя рассматривать как обычное перемещение. В 1925 г. австрийский физик Э. Шредингер предложил для описания движения микрочастиц использовать выведенное им уравнение, связывающее энергию, координаты и волновую функцию — величину, характеризующую свойства волны в квантовой механике. Это уравнение является фундаментальным уравнением квантовой механики.
Путем решения этого уравнения можно определить величины энергии, которой может обладать электрон в атоме (энергетические уровни), и области пространства, где наиболее вероятно нахождение электрона. Область, где вероятность обнаружения электрона составляет не менее 95%, называется атомной орбиталью. Она характеризуется определенной формой и расстоянием от ядра. Каждая орбиталь имеет три характерных квантовых числа, как бы номер квартиры, в которой живет электрон. Квантовые числа определяют уровень энергии орбитали (главное квантовое число n), форму орбитали и энергию подуровня (орбитальное квантовое число I), направление орбитали в пространстве (магнитное квантовое число m). Для каждого уровня энергии (для каждого главного квантового числа) существует вполне определенный набор подуровней (разных значений орбитальных квантовых чисел), а для тех, в свою очередь, — определенный набор вариантов расположения в пространстве (различных значений магнитных квантовых чисел). Главное квантовое число может принимать любые целочисленные значения от 1 до ∞. Иногда обозначают большими буквами К, L, М... n = ∞ означает, что электрон полностью удален от атома.
|
Самая распространенная шкала электроотрицательности (Э0) была разработана американским ученым Л. Полингом в 1932 г. По этой шкале наиболее электроотрицательному элементу - фтору - приписано значение, равное четырем. Однако связь между Э0, энергией ионизации и сродством к электрону существует. Было показано, что Э0 пропорциональна полусумме этих величин: Э0 = (I + Е)/2, Полученные таким образом значения Э0 хорошо согласуются со шкалой Полинга.
|
На рисунке представлены формы и расположение орбита-лей в пространстве для разных значений орбитальных квантовых чисел. Орбитали с разными значениями I принято обозначать буквами: I = 0 — это s-орбиталь; I = 1(р); I = 2(d) и I = 3(f). На каждом уровне есть только одна s-орбиталь, имеющая форму шара, для которой все положения в пространстве равнозначны. Орбиталь р имеет форму, похожую на гантель, и может быть направлена в пространстве тремя разными способами (по осям координат: px, py, рz). Эти три орбитали различаются значениями магнитного квантового числа. Форма d-орбиталей более сложная: на каждом подуровне имеется пять таких орбиталей. Форма f-орбиталей еще сложнее, их может быть семь.
Распределение орбиталей по энергиям представлено на рисунке. Для того чтобы понять, сколько электронов может находиться на каждой орбитали, необходимо учесть еще одно свойство электрона — его собственный магнитный момент. Оказалось, что электроны отличаются друг от друга величиной магнитного момента и характеризуются еще одной квантовой величиной, не связанной с их взаимодействием с ядром. Это спиновое квантовое число ms, или просто спин (от англ. spin — «вращение»), которое может иметь только два значения: +1/2 и -1/2.
Для построения электронной модели атома надо воспользоваться следующими принципами заполнения орбиталей электронами.
Принцип наименьшей энергии. В первую очередь заполняются орбитали с наименьшей энергией, и если записать индексы орбиталей в краткой форме, то по величине энергии они распределятся так: 1s < 2s < 2р < 3s < 3р < 4s < 3d< 4р < 5s < 4d < 5р < 6s < 4f < 5d < 6p < 7s < 6d < 5f.
|
Согласно правилу распределения орбиталей по энергиям (правилу Клечковского), ниже по энергии находится та орбиталь, для которой сумма значений главного и орбитального квантового числа (п + 1) минимальна. При равенстве суммы n + 1 ниже по энергии находится орбиталь с меньшим значением п. Например, для орбиталей 3d: п + 1 = 3 + 2 = 5,
для 4s:
и для 4р:
Схема строения атома фтора
1 - ядро; |
Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковы, то есть на одной орбитали (она характеризуется тремя квантовыми числами) может находиться только два электрона с разными значениями спинового квантового числа.
Правило Хунда. В пределах одного подуровня (то есть на орбиталях с одним и тем же значением 1 электроны распределяются так, чтобы суммарный спин был максимален. Это значит, что сначала на каждой орбитали данного подуровня располагается по одному электрону. Лишь после того, как все орбитали будут заняты, на них может появиться второй электрон. Следует отметить, что приведенные правила справедливы для основного состояния атома — состояния с наименьшей энергией.
Современные методы исследования позволяют определить размеры атомов и их энергетические характеристики. Энергия испускаемого (или поглощаемого) излучения, которое возникает при переходе электронов с одного энергетического уровня на другой, соответствует разнице энергий этих уровней.
Важнейшими энергетическими характеристиками атома являются потенциал ионизации и сродство к электрону. Эти параметры необходимы для понимания природы химической связи, магнитные свойства, в частности — диамагнетизм и парамагнетизм.
Диамагнитными называются частицы, которые не взаимодействуют с магнитным полем (не втягиваются в магнитное поле), что обусловлено отсутствием у них собственного магнитного момента (нет неспаренных электронов).
Парамагнитные частицы, напротив, имеют
неспаренные электроны и обладают собственным магнитным моментом, поэтому они
взаимодействуют с магнитным полем (втягиваются в него).
Основываясь на современных представлениях об электронном строении атома, можно логически вывести периодические закономерности в изменениях свойств химических элементов. Каждый новый энергетический уровень по своей конфигурации напоминает предыдущий. Например, литий Li на втором энергетическом уровне имеет один электрон (2s1), натрий Na на третьем уровне — 3s1 электрон, а калий К на четвертом один — 4s1. Периодичность свойств химических элементов основана на тождественности конфигураций внешних электронных орбиталей атомов в невозбужденном состоянии (эти электроны ответственны за химические свойства) и определяется периодичностью повторения строения внешних электронных уровней.
|
в современной иностранной литературе принят так называемый длиннопериодный вариант Периодической таблицы. В ней нет побочных подгрупп, а периоды с четвертого по восьмой имеют восемнадцать групп. Первые две группы объединяют s-блок элементов, последние шесть включают р-блок, а десять групп длинных периодов - d-блок. Так же как и в коротком варианте, f-элементы выделены в отдельные семейства.
|
Так, элементы группы галогенов (F, СL, Вг, I, At), обладающие похожими химическими свойствами, имеют на внешнем электронном уровне семь электронов (ns2np5), щелочные металлы (Li, Na, К, Rb, Cs, Fr) — один электрон (ns1), а элементы V, Nb, Та — пять электронов (п - l)d3ns2.
Периодическая система элементов — это графическое изображение периодического закона. Наиболее распространенным является клеточный вариант Периодической таблицы. Разновидность клеточного варианта, так называемый короткий вариант, который широко используется в нашей стране, представлен на рисунке.
|
Академик А. Ф. Иоффе предположил, что олово может иметь кристаллическую структуру алмаза и обладать свойствами полупроводников. Он исходил из того, что ближайшие соседи олова по Периодической таблице - германий Ge и кремний Si - имеют кристаллическую решетку, подобную структуре алмаза, и являются полупроводниками. Для проверки этого предположения ученый вырастил кристалл в растворе олова в ртути при температуре - 650° С. Таким образом, предположение А. Ф. Иоффе полностью подтвердилось. И хотя практического применения кристаллы серого олова не нашли - очень уж они хрупки и трудно их вырастить, замечательно, что на основании Периодического закона были предсказаны кристаллическая структура и свойства вещества.
|
СТРУКТУРА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ ЭЛЕМЕНТОВ. Периодическая таблица состоит из вертикальных рядов, называемых группами, и горизонтальных — периодов.
Периоды объединяют элементы, в атомах которых происходит заполнение одинаковых электронных уровней. При этом номер периода совпадает с номером этого внешнего уровня. Например, 2-й период объединяет элементы, у которых заполняется второй уровень (2s и 2р), от Li (2s1) до Аr (2s22p6) — всего 8 элементов. У элементов 6-го периода внешним электронным уровнем является шестой (6s и 6р) — это Cs (6s1), Nd (4f46s2) и W (4f15d46s2), Bi (4f145d106s26p3), Rn (4f145d106s26p6) — всего 32 элемента. Каждый период заканчивается элементом, относящимся к инертным газам. У них полностью завершен электронный уровень — ns2np6.
Различие в последовательности заполнения электронных уровней внешних и более близких к ядру объясняет причину различной длины периодов; 1-й период — 2 элемента, 2-й и 3-й — по 8 элементов, 4-й и 5-й — по 18, 6-й — 32 элемента. Часто 14 элементов, у которых заполняется 4f- и 5f-подуровни, выносят из Периодической таблицы в отдельные семейства лантаноидов (4f) и актиноидов (5f).
В группы и подгруппы входят атомы элементов, имеющих одинаковое количество электронов на внешнем уровне. Для s- и р-элементов (т. е. для элементов, у атомов которых заполняются внешние s- и р-уровни) номер группы соответствует общему числу электронов на внешнем уровне. Например, в V группе пять электронов: N (2s22р3), Р (3s23p3), As (4s24p3), Bi (6s26p3), во II группе — два: Be (2s2), Ca (3s2), Ra (6s2). Эти s- и р-элементы объединяются в главные подгруппы.
Для d-элементов (т. е. для элементов, у атомов которых заполняются d-уровни) номер группы в общем случае (для первых 6 элементов каждого семейства d-элементов) равен общему числу электронов на (п - 1)d- и ns-уровне. Например, у Sc (3d14s2), находящегося в III группе, три электрона. Таким образом, открытие строения атома объяснило периодичность изменения свойств элементов.
Вещества состоят из молекул, которые, в свою очередь, образованы атомами. Атомы в молекулах удерживаются химическими связями, а молекулы в веществе — за счет межмолекулярных взаимодействий.
Молекула представляет собой мельчайшую устойчивую электронейтральную частицу вещества, обладающую его химическими свойствами. При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию устойчивой многоатомной системы — молекулы. Считается, что атомы образуют молекулу, если при их сближении потенциальная энергия системы уменьшается. Химическая связь имеет электростатическую природу, т. е. она основана на электростатическом взаимодействии всех ядер и электронов.
|
Межмолекулярные взаимодействия, будучи достаточно слабыми, тем не менее требуют к себе «уважительного отношения». Так, однажды весной в США при температуре 15° С взорвался газопровод. При изучении обстоятельств взрыва в трубе было обнаружено белоснежное вещество с запахом газа, закупорившее газопровод. Им оказалось новое соединение, состоящее из газа и воды: СnН2n+2(Н2О)х. Газ и вода в нем не были связаны обычными химическими связями - образовалось соединение включения (клатраты).
Изменение энергии в зависимости от расстояния при сближении двух атомов водорода. |
На рисунке показано изменение энергии системы при сближении двух атомов водорода. На некотором расстоянии r1 начинается взаимодействие электрона первого атома ё1 с ядром второго, а электрона второго атома ё2 — с ядром первого. При сближении до некоторого малого расстояния r0 начинают играть роль силы отталкивания двух ядер и энергия системы резко повышается. Это расстояние r0, при котором эти силы компенсируют друг друга и система обладает наименьшей энергией, соответствует расстоянию между атомами в молекуле, и энергия есть энергия связи E0. В этом случае говорят, что между атомами возникла химическая связь.
Так же как и для отдельного атома, для молекулы тоже можно определить вероятность нахождения электронов в пространстве и их энергию. Однако это очень сложно, и поэтому при описании химической связи используют некоторые приближения. Таким приближением является рассмотрение различных типов химической связи:
|
|
Основными характеристиками молекулы являются ее строение и энергия образования. Строение и свойства молекул можно определить экспериментально. Геометрическое строение молекулы определяется межъядерными расстояниями г и валентными углами (углы между линиями, проходящими через ядра). Например, для молекулы воды: rOH = 0,096 нм, rHOH = 104,5°.
Прочность молекулы определяется энергией связи. Для разрыва связей в молекуле воды с образованием атомов (Н2О = 2Н + О) необходима энергия в количестве 928 кДж/моль. Следовательно, энергия каждой связи EO-H = 464 кДж/моль.
Другие физические характеристики молекул, в том числе магнитный момент, дипольный момент, потенциал ионизации, также дают ценную информацию о строении молекул.
|
Информацию о строении молекул можно получить,
исследуя спектры поглощения или испускания. Спектры молекул
значительно сложнее спектров атомов и состоят не из отдельных линий,
а из полос.
|
КОВАЛЕНТНУЮ СВЯЗЬ можно считать наиболее общим типом химической связи, а ионную и металлическую — предельными ее случаями, хотя и обладающими определенной спецификой. Поэтому подробно рассмотрим ковалентный тип связи. Существуют две основные современные модели (теории), объясняющие образование ковалентной связи — метод валентных связей и метод молекулярных орбиталей. Обе эти модели основаны на квантово-механических представлениях, однако метод валентных связей более нагляден и прост.
Метод валентных связей позволяет объяснить геометрическое строение молекул и сравнивать их прочность. Чтобы понять, как это делается, рассмотрим, как в рамках этой модели описывается: а) образование связи; б) направление связи в пространстве и в) оценивается прочность связи.
Метод валентных связей — это современное развитие теории Льюиса о том, что два атома совместно владеют одной (или более) парой электронов. Согласно методу валентных связей, связь образуется при перекрывании электронных орбиталей двух атомов и объединении в общее пользование двух электронов (двухэлектронная, двухцентровая связь).
Образование такой связи может происходить по двум механизмам: или оба атома предоставляют по одному электрону, или один атом (донор) предоставляет пару электронов, а другой (акцептор) — пустую орбиталь (донорно-акцепторный механизм). Результат будет один и тот же: 2 орбитали перекрылись, на них находятся 2 электрона.
|
Исследования в области видимого и ультрафиолетового спектра позволяют изучить электронные переходы в молекуле и определить такие ее характеристики, как энергии молекулярных орбиталей, энергию ионизации и энергию химической связи. Исследования в инфракрасной области спектра позволяют исследовать колебания молекул. Атомы в молекулах могут колебаться либо вдоль линий их валентных связей (валентные колебания), либо за счет изменения валентных углов (деформационные колебания). Энергии этих переходов зависят от прочности связи и формы молекул. В свою очередь, вращательные спектры обусловлены массой и опять же формой частиц. Поэтому на основании колебательных и вращательных спектров можно судить о пространственной структуре молекул, межъядерных расстояниях и валентных углах, прочности и кратности связи.
Схема образования δ- и π-связей. |
По донорно-акцепторному механизму возникает связь, например, между протоном и молекулой аммиака при образовании иона аммония. Причем после того как связи образовались, нет никаких различий между всеми четырьмя связями N - H.
Ионная связь — это связь, осуществляемая в результате электростатического взаимодействия между положительно заряженным ионом — катионом — и отрицательно заряженным ионом — анионом. Частицы, состоящие из одного или более атомов и имеющие электрический заряд, называются ионами. Способность атомов образовывать простые ионы (состоящие из одного элемента) определяется их электронным строением. Катионы легко образуют атомы с малой величиной потенциала ионизации I, в первую очередь щелочные и щелочноземельные металлы. Анионы образуют атомы элементов с большим сродством к электрону, это — кислород и галогены. Соединениями с ионным типом связи являются фторид кальция СаF2, хлорид натрия NaCL, оксид бария ВаО. Ионную связь образуют также сложные ионы. Так, сульфат аммония (NH4)2SO4 состоит из ионов NH4+ и SO42-.
Электрические поля ионов равномерно распределяются в пространстве, поэтому нет определенного направления образования ионной связи, в отличие от ковалентной. Ионную связь отличает от ковалентной и то, что количество ближайших соседей — координационное число (КЧ) — не зависит от строения атома, а определяется только размером ионов. Это связано с неполной взаимной компенсацией полей при взаимодействии двух ионов.
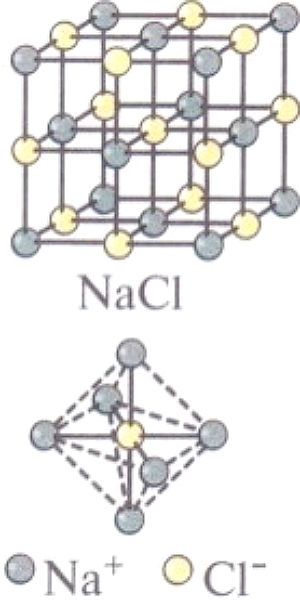
По этим причинам ионы стремятся окружить себя максимальным числом ионов противоположного знака, образуя структуры, называемые ионными кристаллами. Так, в кристалле NaCL, имеющем кубическую структуру, построенную из ионов Na+ и СL-, КЧ и хлора, и натрия равно 6. Хлорид цезия CsCL, где катион Cs+ гораздо больше катиона Na+ имеет другую кристаллическую решетку — кубическую объемноцентрированнyю, и КЧ хлора и цезия равно 8.
|
|
Металлическая связь осуществляется за счет взаимодействия катионов и делокализованных электронов, образующих кристаллическую решетку. Такая связь бывает только в твердых веществах. В тех случаях, когда металлы существуют в виде двухатомных молекул в газовой фазе, например Li2, связь между атомами ковалентная, неполярная. Металлическую связь также можно считать предельным случаем ковалентной связи. Для того чтобы это понять, рассмотрим понятие делокализации электронов. При образовании π-связей могут перекрываться р-орбитали более чем двух атомов. Особенно четко это проявляется в молекуле бензола С6Н6, где негибридизованные р-орбитали всех шести атомов углерода перекрываются по всей окружности «кольца». В результате электроны этих орбиталей делокализованы, т. е. свободно перемещаются между всеми шестью атомами углерода. Такая делокализация электронов приводит к выигрышу в энергии, например, при образовании бензола этот выигрыш составляет 200 кДж/моль.
|
Основным методом изучения строения кристаллов является рентгеноструктурный анализ. Рентгеновские лучи, проходя через кристаллическую решетку, отражаются от ее узлов, отклоняются и интерферируют. Полученная при этом дифракционная картина воспроизводится на фотопленке в виде совокупности пятен - максимумов интерференции рентгеновских лучей. По положению пятен устанавливают пространственнное расположение частиц в кристалле. Кроме того, по рентгенограммам можно определить параметры кристаллической решетки, межъядерные расстояния и эффективные радиусы частиц, образующих кристалл.
|
В случае графита, где слои образованы sp2-гибридными орбиталями углерода, связь между слоями осуществляется делокализованными электронами р-орбиталей ближайших слоев. Это приводит к тому, что между слоями электроны движутся беспрепятственно, и поэтому графит проводит электрический ток, В металлах же связь осуществляется за счет делокализованных электронов по всему объему огромной молекулы — металлического кристалла.
Атомы металла в кристаллической решетке «упакованы» так, что промежутки между атомами минимальны. Металлы имеют плотноупакованные структуры. КЧ для металлов определяются строением кристаллических решеток. Основными кристаллическими решетками металлов являются: гексагональная, кубическая гранецентрированная и кубическая объемноцентрированная. КЧ в первых двух структурах равны 12, а в третьей — 8.
Положение электронов в молекулах с разным типом связи отличается только степенью локализации электронов, ионная и металлическая связи действительно являются предельными случаями кавалентной связи.
Более общим методом, который описывает в рамках единой модели все типы межатомных связей, является метод молекулярных орбиталей. Основное положение этого метода заключается в том, что все электроны молекулы принадлежат всем ядрам, и в результате образуется многоэлектронная многоцентровая структура. Все электроны находятся не на атомных, а на отличных от них молекулярных орбиталях. Однако описание молекулярных орбиталей с помощью данной модели очень сложно и требует дополнительных знаний физики и математики.
 |
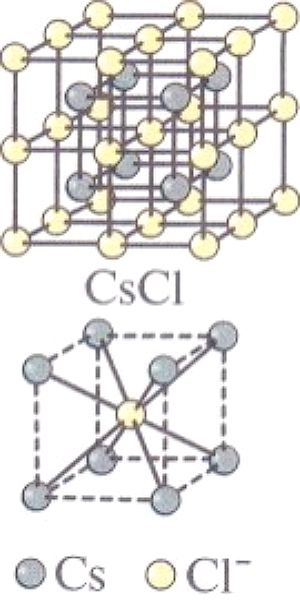 |
| Кристаллические решетки и координационные полиэдры NaCL и CsCL. | |
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ выполняют функции удерживания молекул друг с другом и образования вещества, состоящего из множества молекул, с которыми мы имеем дело практически. Чем сильнее взаимодействие, тем выше значения температур кипения и плавления веществ. Самые слабые взаимодействия между молекулами характерны для газов. Чем больше молекула и чем больше она содержит разных атомных групп, тем большую роль играют межмолекулярные взаимодействия. Наиболее заметны они в белках, нуклеиновых кислотах, полисахаридах и других полимерных молекулах.
Полярные молекулы, например НСL, представляющие собой диполь, удерживаются диполь-дипольным взаимодействием (электростатическим взаимодействием между положительным концом одного диполя и отрицательным концом другого).
В кристаллах неполярные молекулы, например I2, удерживаются также электростатическими силами. Взаимодействие неполярных молекул называют дисперсионным или ван-дер-ваальсовым. Суть его заключается в том, что неполярная молекула за счет флуктуации электронов в какой-то момент времени может превратиться в диполь — мгновенный микродиполь. Взаимодействие этих мгновенно наведенных диполей и удерживает молекулы в кристалле.
Ван-дер-ваальсовы силы очень слабые. Так, если энергия связи СL - СL составляет 243 кДж/моль, то энергия связи между молекулами в кристалле хлора — 25 кДж/моль.
|
|
Особым типом межмолекулярного взаимодействия является водородная связь — это связь между атомом водорода одной молекулы с электроотрицательным атомом другой молекулы. Наиболее сильные водородные связи возникают при взаимодействии водорода с N, О и F. Водородную связь может образовывать только атом водорода, связанный с электроотрицательными атомами, смещающими на себя электронную плотность, создавая тем самым эффективный положительный заряд на водороде Н8+. Например, в молекуле спирта водородную связь с другими молекулами может осуществлять только атом водорода, связанный с кислородом (стрелка указывает направление смещения пары электронов):
СН3 - СН2 - О ← Н.
Природа водородной связи двоякая: с одной стороны, это диполь-дипольное, а с другой — донорно-акцепторное взаимодействие между парой электронов электроотрицательного атома и практически свободной орбиталью водорода.
|
Наиболее сильные водородные связи существуют в воде. Многие удивительные свойства ее как раз и обусловлены наличием водородных связей. Так, плотность льда меньше плотности жидкой воды. Это связано с тем, что молекулы воды во льду связаны с четырьмя другими молекулами водородными связями и образуют объемную решетку. При плавлении часть водородных связей рвется, молекулы сближаются и плотность воды увеличивается, Однако при температуре, близкой к температуре плавления (0° С), не все водородные связи, образующие лед, рвутся. Остаются большие агрегаты, которые разрушаются лишь при нагревании. Наибольшую плотность вода имеет при 4° С.
Схема кристаллической решетки льда. |
Наличие водородных связей в химических веществах приводит к:
1) повышению температуры плавления и кипения (так, в ряду водородных соединений неметаллов — Н2О, NH3, HF — температура кипения аномально высока из-за усиления связи между молекулами в жидкости);
2) увеличению растворимости их в воде за счет образования водородной связи между молекулами воды и растворенного вещества, например, NH3, спирты, амины;
3) существованию полимеров даже в газовой фазе, например, в парах две молекулы уксусной кислоты связаны между собой водородной связью (димер);
4) ориентации полимерных молекул, например, в молекуле ДНК внутримолекулярные водородные связи между парами оснований.
|
Изменение температуры кипения водородных соединений в периоде. |
Гидрофобные взаимодействия — это взаимодействия между частицами (молекулами или их неполярными группами), не способными к образованию водородных связей (так называемыми гидрофобными частицами) в водной среде. Причина подобных слабых взаимодействий заключается в том, что, попав в воду, такие молекулы не в состоянии разорвать водородные связи и образовать истинный раствор. При их взаимодействии друг с другом образуются агрегаты. Например, масло на поверхности воды собирается в каплю в результате гидрофобных взаимодействий.
Водородная связь и гидрофобные взаимодействия занимают большое место в химических процессах, протекающих в живых организмах и растениях. Так, устойчивость пространственного расположения белковых молекул определяется последовательностью расположения водонерастворимых аминокислотных остатков. Гидрофобные взаимодействия участвуют в процессах образования и стабилизации водных суспензий — латексов, жировых эмульсий и др.
|
Водородные связи между ларами оснований в молекуле ДНК. |
ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ являются главными понятиями, определяющими химические свойства атома. С одной стороны, валентность — это способность атомов образовывать химическую связь, а с другой — число химических связей, которыми атом соединен с другими атомами в молекуле. Это понятие применимо к ковалентным молекулярным соединениям, т. е. к соединениям, состоящим из дискретных молекул (газам, жидкостям и молекулярным кристаллам). Современная теория валентных связей, опирающаяся на электронное строение атома, определяет валентность атомов для этих соединений как количество двуэлектронных связей. Например, в молекуле NH3 атом азота образует с каждым атомом водорода по одной связи: валентность азота равна трем, водорода — единице. В молекуле N2 каждый атом азота связан с другим тремя связями: валентность азота равна трем. (Атом азота имеет три р-орбитали, на которых находится по одному электрону, и эти орбитали, перекрываясь, дают одну s- и две р-связи.) Валентность всегда выражается целым положительным числом.
Понятиями, характеризующими атомы в твердых кристаллических веществах (весь кристалл представляет собой как бы единую огромную молекулу), являются структура — расположение атомов в кристаллической решетке — и КЧ — число ближайших соседей.
|
Межмолекулярные взаимодействия тем сильнее, чем
больше размеры атомов и молекул. Чем сильнее межмолекулярные связи,
тем больше теплоты надо сообщить системе, чтобы разорвать их и дать
возможность молекулам перемещаться более свободно. Поэтому
температура плавления молекулярных кристаллов повышается при
увеличении размеров молекул. (Тпл. CL2 = -101° С, Тпл. Вr2 = -7,2° С, Тпл. I2 = 113,5° С). Или другой пример: углеводороды (СnН2n+2) при комнатной температуре - газы, если n = 5, жидкости, если n = = 5 - 7, и твердые вещества, если n > 7.
СаF2 |
Так, в кристалле СаF2 каждый атом фтора окружен четырьмя атомами кальция (КЧ = 4), а каждый атом кальция — восемью атомами фтора (КЧ = 8). К твердым структурам понятие валентности не вполне применимо еще и потому, что в некоторых веществах (бертоллидах) не выполняется закон постоянства состава.
В химии комплексных соединений вместо валентности применяется понятие КЧ, хотя в этих соединениях образуется обыкновенная ковалентная связь, хорошо описываемая теорией валентных связей. Например, в хлориде гексаамминкобальта(III) [Co(NH3)6]CL3 КЧ кобальта равно 6.
Валентности атомов иногда изображаются графически в виде черточек, каждая черточка означает одинарную связь. Например, молекула оксида азота (II) выглядит как: N = О. Графические формулы удобны, так как наглядно демонстрируют последовательность соединения атомов в молекулах. Наиболее широко они используются в органической химии. Другим понятием, связанным с химической связью, является степень окисления (СО) — величина, показывающая, какой заряд был бы на атоме, если предположить, что соединение ионное и электроны полностью смещены к более электроотрицательному атому. СО обозначают арабской цифрой со стоящим после нее знаком « + » или « - » вверху справа от символа элемента. Величина СО формальна, поскольку абсолютно ионными связи не бывают.
Подавляющее большинство твердых тел имеет кристаллическое строение. Кристаллохимия изучает взаимосвязь геометрического строения кристаллов с особенностями химической связи частиц, их образующих, а также соотношения между кристаллической структурой вещества и его свойствами.
 |
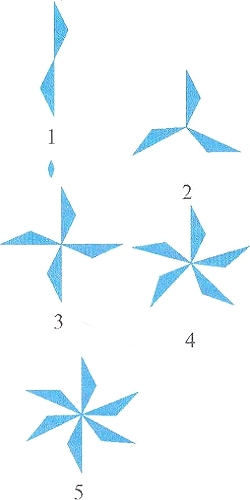 |
| Фигуры, имеющие оси симметрии 2, 3, 4, 5 и 6-го порядка (соответственно 1 - 5). | |
КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА - это твердые тела, в которых частицы (атомы, молекулы или ионы) периодически правильно повторяются в трех измерениях, образуя бесконечную структуру. Частицы, расположенные в пространстве в определенном порядке, образуют кристаллическую решетку.
Симметрия и порядок — вот отличительные характеристики кристаллов. Симметричными называют тела, состоящие из равных, одинаковых частей, которые могут быть совмещены друг с другом. Существует много различных элементов симметрии: плоскость, ось, центр симметрии, трансляция и другие. Одним из главных элементов симметрии является плоскость симметрии. Предмет имеет плоскость симметрии, если две его части можно совместить друг с другом только путем отражения в плоскости симметрии, как в зеркале. Так, у бабочки плоскость симметрии проходит вдоль брюшка.
Другой очень распространенный тип симметрии — ось симметрии. На рисунке показаны фигуры, обладающие такими осями. Если представить себе ось, проходящую через центр фигуры, то при повороте вокруг нее треугольники совместятся друг с другом. Чтобы части первого узора совместились, надо повернуть его на пол-оборота. Такой узор имеет ось второго порядка. Второй узор надо повернуть на 120° — у него ось третьего порядка. Понятия об элементах симметрии широко используются в стереохимии, изучающей пространственное строение молекул.
Все кристаллы симметричны. Это значит, что в них можно найти различные элементы симметрии. Элементы симметрии могут сочетаться друг с другом только по строгим математическим законам. Всего таких сочетаний для кристаллических структур может быть 230. Их называют федоровскими пространственными группами в честь кристаллографа Федорова, который одновременно с немецким математиком Шенфлисом в конце XIX в. вывел эти законы.
Элемент симметрии — трансляция — возможен только в бесконечных фигурах. Трансляция — это перенесение деталей структуры параллельно самим себе вдоль какого-либо направления.
 |
| Узор (если его считать бесконечным) имеет элемент симметрии - трансляцию. |
В кристаллической решетке можно выделить наименьший параллелепипед, при перемещении (трансляции) которого в трех измерениях получится весь кристалл. Такая структурная единица называется элементарной ячейкой.
Всего существует 14 элементарных трехмерных геометрических ячеек, или решеток, названных по имени французского ученого, установившего их, Бравэ.
ПО ТИПАМ ХИМИЧЕСКОЙ СВЯЗИ кристаллы подразделяются на металлические, ионные, молекулярные и макромолекулярные или ковалентные. В последних связи атомов в кристалле ковалентные, и геометрия кристалла во многом зависит от электронного строения атома и его возможности образовывать определенное количество связей. Так, алмаз построен из атомов углерода, связанных одинарными ковалентными связями, направленными к вершинам тетраэдра. В случае же другой модификации углерода — графита — кристалл построен из слоев, состоящих из сетки атомов углерода, связанных друг с другом тремя связями. Разный тип связи в кристаллах приводит к различиям в свойствах твердых веществ.
|
В 1960 г. на конгрессе Международного союза кристаллографов была представлена выставка работ голландского художника Маурица Эшера. Картины Эшера представляли собой мозаичные узоры, в которых одно изображение было вписано в другое так, что фигуры периодически повторялись и между ними не было пустых мест. Художник интуитивно открыл законы сочетания элементов симметрии, являющиеся законом расположения частиц в кристаллах: бесконечное повторение одинаковых групп без промежутков и нарушений.
|
Химические свойства кристаллических веществ также зависят от их структуры. Например, простое вещество фосфор Р может существовать в двух модификациях — белый и красный фосфор. Белый фосфор имеет молекулярную кристаллическую решетку, а красный — ковалентную решетку.
Белый фосфор растворяется в щелочах при нагревании, а красный — нет. Вещества, имеющие однотипные кристаллические структуры, обладают похожими химическими свойствами.
Так, оксиды хрома и алюминия (Сr2О3 и AL2O3) не растворяются в растворах кислот и щелочей.
Химическая дисциплина, изучающая закономерности протекания химических превращений на основе общих физических законов, называется физической химией. В физхимии существует два главных раздела — химическая кинетика и химическая термодинамика. Главные вопросы, которые нужно решить химику, — это пойдет ли химическая реакция, а если пойдет, то каков будет выход получившегося вещества, а также как надо изменить условия проведения реакции, чтобы выход продуктов был оптимальным, а скорость процесса приемлемой.
|
|
 |
|
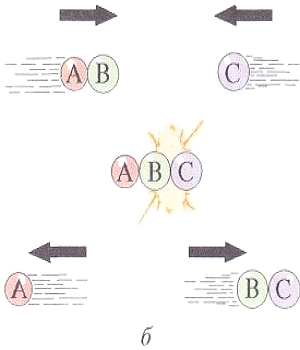
Схема возможных соударений молекул: а -
энергии молекул недостаточно для протекания химической реакции; |
|
ХИМИЧЕСКАЯ КИНЕТИКА изучает качественные и количественные изменения в химических процессах, происходящих во времени, т. е. механизмы химических реакций и скорость их протекания. Механизм реакции — это последовательность стадий превращения исходных веществ, вступающих в реакцию, в конечные продукты реакции.
Для возникновения химической реакции необходимо, чтобы реагирующие частицы столкнулись и имели достаточный запас энергии.
При столкновении двух молекул, обладающих достаточно большой энергией, возможно преодоление взаимного отталкивания электронов и достаточно близкое соприкосновение атомов. При этом будет происходить и перераспределение электронов — разрыв старых связей и образование новых, т. е. начнется химическая реакция. Схема возможных соударений частиц АВ и С и образование ВС и А по реакции АВ + С = А + ВС представлена на рисунке.
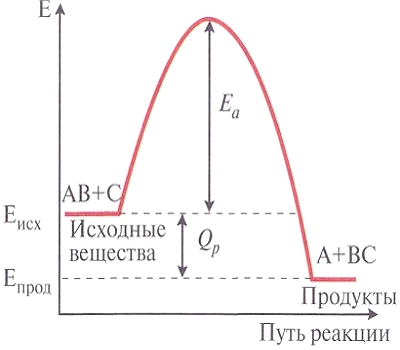
Необходимая энергия, которой должна обладать молекула для вступления в химическую реакцию, называется энергией активации Еа. Этот процесс иначе представляют на так называемых энергетических диаграммах. Еа— это как бы энергетический барьер, который должна преодолеть молекула. Очевидно, что чем больше молекул перепрыгнет через такой барьер, тем выше будет скорость химической реакции.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ — это число соударений (элементарных актов реакции), приводящих к химическому превращению в единице объема в единицу времени. На практике скорость реакции определяется как изменение концентрации реагирующих веществ в единицу времени. Например, на рисунке изображен график уменьшения концентрации пероксида водорода во времени для реакции его разложения:
2Н2О2 = 2Н2О + О2.
За интервал времени ∆t = t2 - t1 концентрация пероксида водорода изменилась на ∆С = C1 - С2. Скорость реакции в этот промежуток времени можно рассчитать по формуле, которая называется кинетическим уравнением: v = ∆С/t.
 |
 |
| Энергетическая диаграмма химической реакции. | Кинетическая кривая реакции разложения Н2О2. |
Можно ли изменить скорость химического процесса? Чтобы ответить на этот вопрос, нужно понять, от каких факторов зависит скорость химической реакции. Скорость химической реакции определяют:
природа реагирующих веществ;
концентрация реагирующих веществ;
температура;
наличие катализатора;
величина поверхности раздела (для гетерогенных реакций);
прочие энергетические воздействия (световое, радиационное облучение и др.).
Зависимость скорости реакции от концентрации реагирующих веществ выражает основной закон химической кинетики — закон действия масс. Он формулируется так: скорость химической реакции при постоянной температуре прямо пропорциональна произведению мольных концентраций реагирующих веществ. Чем больше концентрация исходных веществ, тем выше вероятность соударений молекул, тем больше скорость реакции. Этот закон был открыт опытным путем норвежскими учеными К. Гульдбергом и П. Вааге в 1867 г.
Различие между порядком реакции и спихиометрическими коэффициентами обусловлено сложным механизмом реакции.
Механизм реакции — это последовательность стадий перехода исходных веществ, вступающих в реакцию, в конечные продукты. Практически химическое превращение вещества включает в себя несколько элементарных стадий, и скорость реакции в целом будет определяться скоростью самой медленной элементарной стадии, называемой лимитирующей стадией.
|
Цепные реакции являются одним из распространенных механизмов реакций. Их особенность заключается в том, что один первичный акт активации приводит впоследствии к превращению огромного числа молекул исходных веществ. Например, хлор и водород при обычной температуре в темноте не реагируют. Однако при действии ультрафиолетового света эта смесь взрывается (скорость реакции огромна). |
По количеству частиц, столкнувшихся в элементарном акте, реакции делятся на мономолекулярные, бимолекулярные и тримолекулярные реакции. Последние очень редки, так как вероятность одновременного столкновения трех частиц чрезвычайно мала. Порядок и молекулярность реакции — два совершенно разных понятия, отражающие различие между полной стехиометрией реакции (суммарное уравнение реакции) и ее механизмом.
|
Атом-радикал очень активен и взаимодействует с
молекулой водорода с образованием молекулы хлороводорода и нового
радикала - радикала водорода. Дальше радикал водорода реагирует с
молекулой хлора, и опять образуется радикал хлора и так далее: Таким образом, превращение происходит через последовательную цепь элементарных стадий. |
|
 |
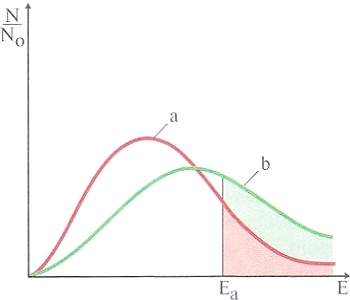 |
| Распределение частиц по энергиям при разных температурах (Т2 > Т1). | |
Зависимость скорости реакции от температуры. Если оставить красный фосфор на воздухе, он может лежать без видимых изменений очень долго. Но стоит его немного нагреть — он мгновенно сгорит (произойдет реакция окисления его кислородом воздуха). Чтобы тесто быстрее подходило (быстрее шла реакция брожения), его ставят в тепло. При повышении температуры скорость элементарной реакции всегда увеличивается. Однако объяснение этого факта тем, что увеличение скорости движения частиц приводит к более частому их столкновению при нагревании, не согласуется с экспериментальными данными. При повышении температуры на 10° С скорость химической реакции увеличивается в среднем в 2 - 4 раза (правило Вант-Гоффа). Простое увеличение частоты столкновений молекул не может привести к столь значительному эффекту. Если средняя энергия исходных веществ меньше энергии активации, встает вопрос, сколько же частиц обладает энергией, большей Eа. На рисунке представлено распределение частиц по энергиям. Количество частиц, имеющих запас энергии больше Еа, пропорционально заштрихованной площади под кривой α. При повышении температуры распределение частиц по энергиям меняется (кривая б). Энергия активации не зависит от температуры и постоянна для данной реакции. Количество частиц, обладающих достаточной энергией (Е > Eа), увеличивается в несколько раз, и пропорционально этому возрастает число результативных столкновений. Это и есть главная причина увеличения скорости реакции при повышении температуры.
Влияние катализатора на скорость реакции. Гомогенный и гетерогенный катализ.
|
Устройство для дожигания выхлопных газов в двигателе внутреннего сгорания. |
Использование катализаторов является одним из важнейших способов влияния на скорость химических реакций.
Катализатор — вещество, изменяющее скорость химической реакции и не расходующееся в процессе реакции. Он специфически действует на определенные реакции, совершенно не влияя на другие. Явление изменения скорости химической реакции под действием катализатора называют катализом.
В зависимости от фазового состояния реагирующих веществ и самого катализатора различают два вида катализа — гомогенный и гетерогенный. При гомогенном катализе между реагирующим веществом и катализатором нет поверхностей раздела, а при гетерогенном — катализатор находится в системе в виде самостоятельной фазы. В этом случае поверхность катализатора играет важную роль в каталитическом процессе. Детальный механизм действия катализаторов сложен. Основной особенностью таких реакций является то, что катализатор, взаимодействуя с реагентами, образует с ними промежуточные соединения. В итоге величина Еа реакции с участием катализатора оказывается ниже Еа такой же реакции в его отсутствие. Практически реакция идет по другому пути. Уменьшение Еа приводит к значительному увеличению числа частиц, обладающих энергией, большей энергии активации, и возрастанию скорости реакции.
|
Энергетическая диаграмма реакции без катализатора (а) и с гомогенным катализатором (б). |
При гетерогенном катализе снижение Еа достигается за счет адсорбции реагентов на поверхности катализатора, что приводит к ослаблению химических связей в адсорбированных молекулах. Катализ играет важную роль и в биохимических процессах. В роли катализаторов там выступают ферменты — сложные белковые соединения.
|
Схема
простейшего калориметра для определения теплоты реакции: 2 -
термометр; 5 - исследуемое вещество. |
ОСНОВНОЙ ЗАДАЧЕЙ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ является определение вероятности протекания той или иной химической реакции или физико-химического процесса. Главное отличие термодинамики от кинетики состоит в том, что здесь важен не механизм реакции, а результат. Прежде всего рассмотрим понятия, которыми оперирует термодинамика. Любое вещество обладает запасом внутренней энергии, складывающейся из потенциальной энергии атомов (энергии взаимодействия ядер и электронов), а также вращательной, колебательной и поступательной энергии частиц, образующих вещество. Абсолютное значение внутренней энергии измерить или рассчитать невозможно, можно лишь определить изменение ее в результате какого-либо процесса. Так, в ходе химической реакции при разрыве одних химических связей и образовании новых может выделяться или поглощаться энергия. Известны две формы передачи энергии от одной системы к другой: теплота и работа. Согласно закону сохранения энергии, если какой-либо процесс совершается с поглощением теплоты, то эта теплота расходуется на изменение внутренней энергии и совершение работы над окружающей средой (например, выделившиеся газы совершают работу расширения):
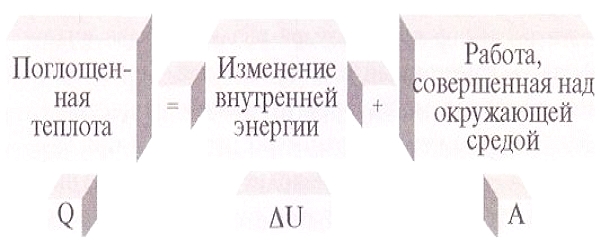 |
Закон сохранения энергии, записанный в такой форме, называется первым законом термодинамики.
ОБРАТИМОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Лишь небольшое количество химических реакций протекает практически полностью (до конца). Необратимыми в термодинамике называются такие процессы, после протекания которых систему уже нельзя вернуть в начальное состояние без того, чтобы не осталось никаких изменений в ней самой или в окружающей среде. Необратимым, например, является растворение цинка в соляной (хлороводородной) кислоте: Zn + 2НСL = ZnCL2 + Н2. Большинство реакций являются обратимыми, т. е. они могут протекать как в прямом, так и в обратном направлении. Через некоторое время от начала реакции скорости прямой и обратной реакций станут равными и в системе установится равновесие. Равновесным состоянием называется такое термодинамическое состояние системы, которое не изменяется во времени. Значит, количество веществ в смеси во времени больше не изменяется.
|
Реакция Н2(г) + l2(r) = 2НI(г) была очень подробно исследована в конце прошлого века. В ампулы помещали либо смесь иода и водорода, либо только иодоводород. После выдержки ампул некоторое время при определенной температуре их содержимое анализировали. Результаты анализа указывали на содержание в каждой ампуле всех трех веществ. Содержание иодоводорода в ампулах было одним и тем же, независимо от начального состава.
Изменение концентрации HI во времени в процессе реакций а и б. |
На рисунке показано изменение концентрации HI в процессе двух реакций:
Н2 + I2 = 2НI(г) (а);
2НI(г) = Н2(г) + l2(r) (б).
С некоторого момента времени (Ʈ = Ʈ0) количество иодоводорода больше не изменяется.
Химическая реакция не прекратилась — просто в состоянии равновесия количество образующегося HI равно количеству разложившегося. Для прямой реакции (а) вначале (при больших концентрациях иода и водорода) ∆Ga < 0, и происходит самопроизвольное образование иодоводорода. ∆G реакции зависит от концентрации реагентов, участвующих в реакции. По мере накопления HI и уменьшения концентрации Н2 и I2∆Gа реакции увеличивается и при некоторых значениях концентраций становится равным нулю. То же самое относится и к обратной реакции (б). Следует помнить, что ∆Gа = -∆Gб. Равновесие достигается при ∆Gа = ∆Gб = 0 — это условие равновесия.
Константа равновесия Кр является количественной характеристикой равновесия и критерием полноты протекания реакции. При достижении равновесия отношение произведения концентраций (парциальных давлений) продуктов реакции, возведенных в степени, равные стехиометрическим коэффициентам, к произведению концентраций (парциальных давлений) исходных веществ есть величина постоянная. Это и есть константа равновесия.
Для реакции образования иодоводорода:
Кр = [HI]2/[H2][I2],
где [] — мольные концентрации (моль/л). Для реакций, протекающих в газовой фазе, чаще константу равновесия выражают не через концентрации, а через парциальные давления р. Например, для реакции образования аммиака N2(r) + ЗН2(г) = 2NH3(r) константу равновесия можно записать следующим образом:
![]()
При значении Кр >> 1 в системе преобладают продукты реакции, т. е. доминирует прямая реакция. Наоборот, если Кр << 1, то преобладает обратная реакция. Константа равновесия зависит только от двух факторов — природы реагирующих веществ и температуры процесса, не зависит от концентрации реагирующих веществ.
Так, если в систему, состоящую из Н2(г), I2(r) и НI(г) и находящуюся в равновесии, добавить дополнительное количество Н2, то скорость прямой реакции сначала возрастет, а затем снова наступит равновесие. При этом концентрация HI увеличится, но величина Кр останется неизменной.
На практике, особенно в химических производствах, важно уметь смещать равновесие химических реакций в нужную сторону.
|
Механизм реакции нельзя предсказать по химическому уравнению; многие механизмы были найдены при интерпретации уравнений скорости реакций. Так, скорость реакции замещения: (СН3)3СВг + ОН- → (СН3)3СОН + Вг- не зависит от концентрации гидроксид-иона и прямо пропорциональна концентрации 2-бром-2-метилпропана, Говорят, что по отношению к ОН- это реакция нулевого порядка, а по отношению к (СН3)3СВг - первого. Чтобы объяснить, почему скорость реакции не зависит от концентрации одного из реагентов, можно предположить, что реакция состоит из нескольких стадий и самая медленная (лимитирующая) проходит без участия гидроксид-иона: (СН3)3СВг → (СН3)3С+ + Вг-. Вторая стадия быстрая и не оказывает существенного влияния на общую скорость процесса: (СН3)3С+ + ОН- → (СН3)3СОН.
|
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ. ПРИНЦИП ЛЕ ШАТЕЛЬЕ. Положение равновесия химических реакций можно изменять путем варьирования концентрации реагирующих веществ, а также условий проведения реакции — температуры и давления.
Если на систему, находящуюся в равновесии, оказывать какое-либо воздействие, то в результате протекающих в ней процессов равновесие может сместиться в том направлении, которое способствует ослаблению этого воздействия. Это утверждение называется принципом Ле Шателье.
При повышении температуры равновесие смещается в сторону эндотермической, а при понижении — в сторону экзотермической реакции. Например, реакция образования аммиака является экзотермической:
N2(r) + ЗН2(г) = 2NН3(г) + Q.
Обратная реакция будет эндотермической. Следовательно, при повышении температуры пойдет реакция разложения и количество аммиака снизится. При этом уменьшится и константа равновесия Кр, которая зависит от температуры.
При повышении давления равновесие смещается в сторону уменьшения общего объема системы. В наибольшей степени влияние давления проявляется в процессах, протекающих с участием газовой фазы.
Согласно принципу Ле Шателье, при увеличении давления равновесие должно сместиться в ту сторону, где давление в системе меньше. Давление оказывается молекулами газа, и чем больше этих молекул, тем давление будет выше, следовательно, равновесие должно сместиться в сторону уменьшения количества молекул газа.
При растворении газов (способ приготовления любого газированного напитка), в частности СО2 в воде: СО2(г) + aq ↔ СО2(р-р), повышение давления увеличивает растворимость СО2, так как 1 моль газа занимает гораздо больший объем, чем тот же 1 моль, растворенный в воде. В бутылках с такими напитками СО2 всегда находится под давлением. При открывании пробки давление в бутылке снижается до атмосферного и происходит бурное выделение СО2 — равновесие системы смещается влево.
|
Образование аммиака - один из важнейших промышленных
процессов. Поскольку эта реакция экзотермическая и идет с
уменьшением количества молей газообразных продуктов, то для
увеличения выхода аммиака необходимо понижать температуру и
увеличивать давление. Однако при низких температурах скорость
реакции мала, поэтому необходимо выбрать оптимальную (не очень
высокую) температуру и использовать катализатор. В производстве
аммиака температура составляет 450 - 500° С, давление - 350 атм.
Дальнейшее повышение давления приводит к удорожанию оборудования,
что снижает экономическую эффективность производства.
|
При увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов, а при увеличении концентрации продуктов реакции — в сторону исходных веществ.
Особенно часто этот способ смещения равновесия химической реакции используют при проведении реакций в растворе. Давление здесь оказывает очень малое воздействие, а температуру удается варьировать лишь в небольших пределах (от температуры кипения до температуры замерзания растворов).
Одной из важных обратимых реакций в растворе является гидролиз. Например, при растворении солей ртути в воде за счет гидролиза образуются мутные смеси, содержащие основные соли ртути:
Нg(NО3)2 + Н2О = Нg(ОН)NО3 + HNO3.
Чтобы получить прозрачный раствор нитрата ртути, надо добавить азотной кислоты, равновесие сместится влево, и основные соли не будут образовываться.
При растворении хлора в воде образуются две кислоты: хлорноватистая НСLO и хлороводородная НСL. Это равновесие сильно смещено влево:
CL2 + Н2О = Н+ + СL- + НСLO.
Чтобы увеличить растворимость хлора, в раствор добавляют щелочь. При этом связываются ионы водорода Н+ + ОН- = Н2О, концентрация их в растворе уменьшается, равновесие смещается вправо, и хлор реагирует практически полностью.
Неживой природой называют окружающий нас мир, объекты которого не могут, в отличие от объектов живой природы, воспроизводить себе подобных. Одной из составляющих природы является атмосфера, которая состоит в основном из смеси газов. Для ее исследования необходимо знать специфику реакций, протекающих в газовой фазе, и газовые законы. Множество проблем, которые встают перед учеными, связано с химией атмосферы — «парниковый» эффект, «озоновые дыры». Две трети Земли покрыто водой, играющей уникальную роль в жизни нашей планеты. Считается, что первые организмы зародились в воде. Ни одно живое существо не может обходиться без нее. Соответственно растворы и реакции в них — одна из основных областей не только неорганической, но и любой другой области химии. В Мировом океане содержатся практически все химические элементы, и научиться добывать их оттуда — одна из приоритетных задач будущего. Однако пока еще основным источником необходимых людям веществ являются недра Земли. Изучением форм существования соединений различных химических элементов, получением и очисткой как раз и занимается неорганическая химия.
|
Распространенность химических элементов в земной коре, % (масс.). Заштрихованный сектор показывает долю всех остальных элементов. |
Что же отличает неживую природу от живой с точки зрения химии? Органическая химия — это в основном химия соединений углерода и некоторых других элементов, и многообразие органических соединений обусловлено множеством способов объединения этих элементов, поскольку углеродные атомы, связываясь друг с другом, могут образовывать разветвленные цепи и кольца. Неорганическая химия изучает соединения всех известных ныне элементов. Их в настоящее время открыто 109, и многообразие неорганических соединений объясняется огромным числом комбинаций, в которых эти элементы могут связываться друг с другом. Чтобы рассмотреть свойства всех соединений любого элемента, пришлось бы написать целую книгу, а то и не одну. Однако можно разделить все соединения на группы веществ, обладающих близкими свойствами, и выделить общие подходы к решению тех или иных задач, касающихся их взаимных превращений. Вот этим главным закономерностям в свойствах неорганических соединений и посвящена данная глава.
Основное понятие всей неорганической химии — химические элементы. Распространенность элементов в земной коре и на Земле в целом неодинакова. В общем случае это связано со строением ядер атомов. Есть элементы, которые вообще не встречаются в природе, а получены искусственно в результате ядерных реакций. Происхождение элементов — одна из основных проблем естествознания, поскольку решение ее может во многом объяснить происхождение всего материального мира и, в частности, распространенность элементов на Земле.
|
Принятие общих правил названия неорганических соединений упрощает процесс обмена научной и технической информацией между учеными-химиками, говорящими на разных языках, что способствует развитию химической науки.
|
ОСНОВНУЮ ИНФОРМАЦИЮ о свойствах химических элементов можно почерпнуть из Периодической таблицы. В ней сосредоточены сведения о строении атома, которые, в свою очередь, позволяют определить возможные степени окисления и, как следствие, формы основных соединений данного элемента, т. е. состав его оксидов, гидроксидов и др. Кроме того, на основании Периодического закона можно выделить группы элементов, обладающих близкими свойствами. Внутри каждой такой группы свойства соединений изменяются определенным образом, аналогично для большинства групп. Знание этих закономерностей облегчает изучение химии элементов.
Соединения элементов столь многочисленны, что для удобства изучения их подразделяют на классы. Классификаций существует довольно много, но наиболее часто под основными классами химических соединений подразумевают оксиды, гидроксиды (кислоты и основания) и соли. Каждая группа таких веществ обладает общими свойствами и способами получения, причем они не зависят от того, какими элементами образованы эти соединения.
Классифицируются не только химические вещества, но и реакции, в которые они могут вступать. В неорганической химии очень важно деление на реакции окислительно-восстановительные и проходящие без изменения степени окисления.
В окислительно-восстановительных реакциях происходит передача электронов от одной частицы к другой и соответственно меняются степени окисления элементов. Этот тип реакций — основа практически всех процессов получения простых веществ и, конечно, химии элементов, образующих соединения с большим числом различных степеней окисления. Одной из разновидностей окислительно-восстановительных реакций является электролиз — химическая реакция с участием электрического тока. Только с помощью электролиза можно получить наиболее сильные окислители, например фтор, и восстановители — щелочные металлы.
К основным реакциям, которые проходят без изменения степени окисления, относятся кислотно-основные реакции.
|
Аррениус Сванте Август (1859 - 1927), шведский физикохимик, член Королевской шведской Академии наук (с 1901). Основные работы посвящены учению о растворах и кинетике химических реакций. На основании своих исследований высказал идею об электролитической диссоциации. Впервые объяснил сущность температурной зависимости скорости реакций. Ввел понятие энергии активации ∆Е и вывел уравнение зависимости скорости реакции от фактора частоты столкновения молекул А, температуры и ∆Е, ставшее одним из основных в химической кинетике (уравнение Аррениуса). Нобелевская премия (1903).
|
Кислота и основание — одни из фундаментальных понятий химии. Хотя они введены очень давно, однозначного их определения не существует. Есть много различных теорий, которые трактуют их по-разному, в зависимости от природы реагирующих веществ. Различие этих концепций состоит не в «правильности», а в том, насколько теория применима к данным условиям.
Наиболее простая — теория Аррениуса — справедлива для водных растворов, и более общая — теория Бренстеда — Лаури, которая интерпретирует понятие кислотно-основных равновесий как «борьбу за протон».
Для понимания теории Аррениуса надо сначала понять, что же происходит при растворении веществ в воде. Это важно еще и потому, что подавляющее большинство химических процессов на Земле происходит в водных растворах или с участием воды. При растворении твердых веществ в воде разрушается кристаллическая решетка, и вследствие взаимодействия с молекулами воды некоторые вещества распадаются на ионы. Такой распад называется электролитической диссоциацией. Образовавшиеся положительные и отрицательные ионы могут свободно перемещаться в растворе, поэтому такой раствор проводит электрический ток. На этом основана возможность проведения реакций под действием электрического тока, т. е. электролиз. Все реакции, протекающие в растворе, — это реакции ионов. Так, если в результате диссоциации образовался ион водорода — протон, то свойства такого раствора будут определяться взаимодействием протона с другими ионами, например с гидроксид-ионами ОН-. Реакция между протонами и гидроксид-ионами, согласно теории Аррениуса, является основной реакцией кислот и основании — реакцией нейтрализации. Соответственно вещества, которые образуют в растворе только катионы водорода, называются кислотами.
Еще одно специфическое понятие неорганической химии — комплексные, или координационные, соединения.
Оно было введено в конце XIX в. для определения сложных соединений ионов или ионов и нейтральных молекул, для которых не выполнялись общепринятые в то время правила валентности. Современный подход к описанию строения молекул полностью подходит и к описанию комплексных соединений, которые в этом отношении ничем не отличаются от любых других молекул. К этому классу соединений относится огромное число неорганических веществ. Кроме того, комплексные соединения ионов металлов с органическими молекулами проложили мостик между органической и неорганической химией. Например, витамин В12 — комплекс кобальта со сложными органическими лигандами. Дальнейшее исследование комплексных соединений с органическими молекулами, входящими в состав живых организмов, привело к образованию нового раздела химии — бионеорганической химии.
|
Кислоту можно определить как вещество,
высвобождающее в воде ион водорода, либо как вещество, которое может
передавать протон, либо как вещество, способное присоединять
электронную пару.
|
Ни химик-исследователь в научной лаборатории, ни технолог на производстве, ни эколог не могут обойтись без химического анализа. Вопрос об определении состава изучаемого объекта настолько важен, что существует отдельная область химии — аналитическая химия, которая разрабатывает подходы и методологию решения этой проблемы. При анализе химических объектов важно установить их состав, а также чистоту, т. е. количество и состав примесей. Последнее является иногда и основной задачей, так как примеси могут кардинально изменить свойства материала, что особенно важно, например, в электронной технике. Современные методы исследования позволяют определять очень малые количества примесей. Однако первоначальный качественный анализ неорганических объектов не так уж сложен и основан на реакциях, которые можно легко провести в любой лаборатории.
Одна из главных задач химии — разработка методов получения
различных веществ. Ее можно разделить на две основных — переработка полезных
ископаемых и синтез различных материалов. Подобные процессы, протекающие при
производстве наиболее важных химических веществ, изучает наука химическая
технология.
Основой материального мира являются атомы химических элементов. Именно они образуют простые и сложные вещества и живые организмы. Все многообразие окружающей нас природы состоит всего лишь из немногим более ста химических элементов.
|
Ядерные реакции, происходившие во Вселенной,
способствовали образованию большого числа элементов и чрезвычайно
увеличили разнообразие форм существования материи. При конденсации
атомов водорода Н и гелия Не возникли первичные звезды.
Коллапс этих звезд под действием гравитации вызвал повышение
температуры и плотности, что привело к слиянию ядер (реакции
ядерного синтеза). Первичные ядерные реакции практически идентичны
тем, которые изучают в последнее время в связи с проблемой
управляемого ядерного синтеза. 5 - 10 МК (1 МК = 106К).
|
ПРОИСХОЖДЕНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ - один из интереснейших вопросов естествознания, поскольку ответ на него во многом объяснил бы и происхождение всего материального мира. Согласно представлениям, возникшим после установления факта расширения Вселенной, около 15 млрд лет тому назад вся наблюдаемая материя была сконцентрирована в точке, которая однажды взорвалась. И этот момент был назван Большим взрывом. Предположительно температура Большого взрыва достигала 109 К, а образовавшиеся сразу после этого элементарные частицы имели столь большую кинетическую энергию, что не способны были объединиться в какие-либо известные сейчас формы. Однако при охлаждении, вызванном расширением Вселенной, движение частиц стало замедляться, и они начали объединяться под действием различных сил. Короткодействующие силы притяжения протонов и нейтронов (сильные взаимодействия) удерживали частицы в ядре. При дальнейшем понижении температуры гораздо более слабые, но более дальнодействующие электромагнитные силы (между заряженными частицами) связывали электроны и ядра, образуя атомы.
Если современная точка зрения верна, то примерно через 2 часа после образования Вселенной температура упала настолько, что в состав основной массы материи могли входить только атомы водорода (89%) и гелия (11%). В известном смысле мало что изменилось с тех пор, поскольку, как показано на рисунке, водород и гелий до сих пор остаются наиболее распространенными элементами во Вселенной.
Среднее относительное содержание химического элемента в какой-либо системе — будь то Земля, Солнечная система или планета — называют его распространенностью, или кларком. Название было предложено А. Е. Ферсманом в честь американского геохимика Ф. У. Кларка, который вычислил в 1889 г. распространенность элементов в земной коре. Количество атомов различных элементов, присутствующих в том или ином космическом объекте, связано со строением ядер атомов и процессами их превращения — ядерными реакциями. Содержание различных элементов в космосе и на Земле немного отличается.
|
Более тяжелые элементы получаются после окончания реакций с участием водородных ядер, когда коллапс звездных ядер приводит к увеличению плотности до 108 кг/м3 (приблизительно в 105 раз больше плотности воды) и температуры до 100 МК.
|
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — это вид атомов, обладающих определенным зарядом ядра, т. е. содержащих определенное количество протонов. При этом ядро химического элемента может включать в себя разное число нейтронов. Атомы с одним и тем же содержанием протонов и разным содержанием нейтронов называются изотопами.
В природе встречаются как стабильные изотопы, способные существовать сколь угодно долго, так и нестабильные, или радиоактивные, которые претерпевают самопроизвольный радиоактивный распад. Ядра могут распадаться как на ядра других элементов (спонтанное деление ядер урана 23892U), так и на ядра другого элемента и одну из элементарных частиц. Такой процесс называют естественной радиоактивностью.
Различают три вида радиоактивного распада, по типу испускаемых частиц.
α-распад. Ядро испускает α-частицу — ядро атома гелия 42Не. Поток α-частиц называется α-излучением.
β-распад. Ядро испускает β-частицу — электрон и позитрон е- и позитрон е+; при этом изменяется число нейтронов или протонов в ядре, так как происходят следующие превращения:
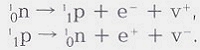
Часть энергии выделяется вместе с нейтрино v+ и антинейтрино v- — элементарными частицами, лишенными заряда и отличающимися спином. Поток β-частиц называется β-излучением.
|
Различные изотопы, в том числе и радиоактивные, находят широкое применение в химии. Например, для проведения анализа с участием «меченых» атомов используют реагенты, содержащие в своем составе радиоактивные изотопы. По результатам анализа на изотоп 146С удалось определить возраст различных объектов на Земле и установить, что древнейшие живые организмы-бактерии - существовали приблизительно 3 - 4 млрд лет тому назад. Данный изотоп углерода образуется и сейчас в верхних слоях атмосферы под действием космических лучей, что поддерживает постоянство его содержания на Земле: 147N + 10n → 146C + 11p.
Проникающая способность различных типов излучений. |
ɣ-распад. Ядро испускает электромагнитное излучение с очень большой частотой и энергией (ɣ-излучение); при этом энергия ядра уменьшается, но ни заряд, ни массовое число его не изменяются, ɣ-распад обычно сопровождает другие ядерные реакции.
При α-распаде образуется ядро атома элемента, расположенного на 2 клетки левее в Периодической таблице элементов и имеющего массовое число на 4 меньше, чем у распадающегося атома, а при β-распаде — на 1 клетку правее, при том же массовом числе.
Кроме естественной радиоактивности существуют также искусственные ядерные реакции, в которых одни химические элементы превращаются в другие при бомбардировке ядер такими частицами, как протоны, нейтроны, α-частицы или более тяжелые ядра. При бомбардировке нейтронами атомов урана-235 протекает одна из самых знаменитых (или бесславных) реакций, происходящая в ядерной бомбе. Путем ядерных реакций были получены многие химические элементы, не существующие в природе, в частности все элементы, следующие за ураном в Периодической системе. Первым элементом, синтезированным таким путем в 1937 г., был технеций (Тс) — 43-й элемент, который образовался при облучении молибдена ядрами дейтерия — изотопа водорода, содержащего два нейтрона:

Важнейшим видом ядерных реакции являются термоядерные реакции, в которых происходит слияние (синтез) атомных ядер в более сложные. Такие реакции сопровождаются выделением огромного количества энергии. Однако и произойти они могут только при очень высоких температурах — более миллиона градусов. Подобные условия осуществимы лишь в недрах звезд, при атомном взрыве или в мощном газовом разряде.
|
Казалось бы, атомная масса должна быть целочисленной величиной: массы протонов и нейтронов, определяющих массу атома, близки к единице. Однако для подавляющего большинства элементов средняя масса атома - дробная величина. Объясняется это тем, что в природе, как правило, существует смесь изотопов данного элемента. Например, есть атомы хлора, содержащие 18 нейтронов, значит, атомная масса изотопа 3517CL приблизительно равна 35 а. е. м. Второй природный изотоп хлора содержит 20 нейтронов, 3717СL, и его масса равна 37 а. е. м. Так как легкого изотопа в смеси 77,5% (ат.), а тяжелого 22,5% (ат.), то средняя атомная масса, которая и приведена в Периодической таблице, равна 35,45. |
Основная информация о химических элементах заключена в Периодической системе Д. И. Менделеева. Например, рассмотрим, что означают индексы и обозначения для седьмого элемента — азота, который находится в V группе второго периода Периодической таблицы.
Порядковый номер соответствует заряду ядра атома и, следовательно, количеству протонов в ядре и электронов в атоме. Атомная масса — это средняя масса атома, выраженная в относительных атомных единицах (а. е. м.).
Иногда в той же клеточке указывают электронное строение последнего энергетического уровня; для азота — 2s2p3. Максимальная положительная степень окисления элементов в подавляющем большинстве случаев численно равна номеру группы. Исключением являются элементы VIII группы (Со, Ni, Rh, Pd, Ir, Pt), инертные газы (He, Ne, Ar, Kr), a также О и F, для которых максимальная степень окисления меньше номера группы, элементы побочной подгруппы Сu, Аg, Аu, для которых степень окисления больше номера группы.
В нашем примере азот, находящийся в V группе, имеет высшую положительную степень окисления +5, например, в таких соединениях, как оксид N2O5 и кислота HNO3.
Минимальная отрицательная степень окисления для элементов IV - VII групп главных подгрупп может быть определена как 8-N, где N — номер группы. Например, для элементов V группы (и азота в том числе) степень окисления равна — 3 (NH3, Са3Р2), для элементов VII группы (галогены) - 1 (HF, КСL).
Закономерно меняются кислотные свойства оксидов и гидроксидов по периодам и группам, что связано с изменением радиусов и степеней окисления элементов. В периодах кислотные свойства оксидов и гидроксидов усиливаются, а в группах ослабевают. Например, азотная кислота HNO3 сильнее угольной и фосфорной (углерод находится в том же периоде, но левее, а фосфор в той же группе, но ниже).
Для того чтобы легче было ориентироваться в огромном многообразии химических веществ, их подразделяют на классы в зависимости от состава и свойств. Деление неорганических веществ на простые и сложные — самая общая классификация. Сложные неорганические вещества обычно разделяют на оксиды, кислоты, гидроксиды и соли.
 |
 |
 |
| Сера - один из наиболее широко применяемых в химической промышленности минералов. | Сталактиты - одна из природных форм полудрагоценного камня малахита. | |
ПРОСТЫЕ ВЕЩЕСТВА состоят из атомов только одного элемента. Их молекулы могут содержать один атом, как у инертных газов (Не, Аг и др.), и два и более атомов (О2, I2, S8, белый фосфор Р4 и др.). Однако если элемент гелий, например, образует простое вещество, молекулы которого состоят из одного атома, то из атомов кислорода могут получиться две различные молекулы; простого вещества кислорода О2 и простого вещества озона О3. Вещества, состоящие из одних и тех же атомов, но имеющие разное их количество в молекуле, называются аллотропными модификациями. Химические и физические свойства таких веществ значительно отличаются. Так, озон — более сильный окислитель, чем кислород, и может, например, окислить серебро.
Молекулы или атомы простых веществ могут быть по-разному расположены друг относительно друга в пространстве. Например, сера состоит из молекул S8, которые могут образовывать либо ромбические, либо моноклинные кристаллы. Вещества, состоящие из одинаковых молекул, но имеющие различное строение в твердой фазе, называются полиморфными модификациями и различаются только по своим физическим свойствам. Углерод образует несколько полиморфных модификаций — алмаз, графит и карбин, которые отличаются расположением атомов в кристаллической решетке. Углерод также имеет и несколько аллотропных модификаций. В 1970 г. была предсказана, а в 1985 г. синтезирована новая модификация углерода — фуллерен, молекула которого состоит из шестидесяти атомов углерода (С60) и своей формой напоминает футбольный мяч.
|
Отсутствие четких границ между кислотными и основными гидроксидами объясняется тем, что в любом гидроксиде есть фрагмент, который можно представить в виде схемы Эδ+---Оδ----Нδ+. Все зависит от того, какая связь, Эδ+---Оδ- или Оδ----Нδ+, менее прочная и соответственно легче рвется. Чем больше эффективный заряд (δ+) у элемента (Э), тем прочнее связь Эδ+---Оδ-, так как она обусловлена силой электростатического притяжения. В свою очередь, тогда связь Оδ----Нδ+ оказывается менее прочной и тем легче отрывается протон (Н+). Соответственно, чем больше эффективный заряд δ+, тем более сильной кислотой будет гидроксид. При малом значении δ+ легче рвется связь Эδ+---Оδ-, и такой гидроксид будет проявлять основные свойства. Если прочности связи Эδ+---Оδ- и Оδ----Нδ+ близки, гидроксид является амфотерным. Например, хром может образовать три гидроксида: Сг(ОН)2, Сг(ОН)3 и Н2СrО4. В этом ряду соединений (слева направо) эффективный заряд на хроме возрастает, так как увеличивается его степень окисления, и соответственно изменяются свойства гидроксидов: Сг(ОН)2 - основание, Сг(ОН)3 - амфотерный гидроксид, а Н2СrО4 - кислота. |
МЕТАЛЛЫ И НЕМЕТАЛЛЫ. Все простые вещества делятся на металлы и неметаллы, резко отличающиеся по своим физическим и химическим свойствам. Основной особенностью металлов является то, что они проводят электрический ток. Однако это деление достаточно условно, так как различные полиморфные модификации одного и того же вещества могут обладать как металлическими (белое олово), так и неметаллическими (серое олово) свойствами. Под давлением почти все простые вещества переходят в металлическое состояние, т. е. связь между атомами становится металлической, и они приобретают свойства проводников.
СЛОЖНЫЕ ВЕЩЕСТВА состоят из молекул, в состав которых входят атомы различных элементов. Существует несколько типов классификаций сложных веществ. Так, бинарные соединения (состоящие из атомов двух элементов) классифицируют по виду одного из атомов: гидриды, оксиды и галогениды — содержат соответственно водород, кислород и галоген, интерметаллиды — содержат только атомы металлов и т. д.
Однако наиболее часто к основный классам неорганических соединений относят оксиды, гидроксиды, кислоты и соли. Взаимосвязь этих классов хорошо видна из таблицы. Родоначальниками всех классов являются простые вещества — металлы и неметаллы. При взаимодействии их с кислородом образуются оксиды (в оксидах кислород имеет степень окисления — 2): S + О2 = SO2; 4АL + ЗО2 = 2AL2O3. Обычно металлы образуют основные и амфотерные оксиды, а неметаллы — кислотные. Прямое или косвенное взаимодействие оксидов с водой приводит к образованию гидроксидов, и, наоборот, при отщеплении воды из гидроксидов получаются оксиды: SO3 + H2O = H2SO4; 2АL(ОН)3 = AL2O3 + ЗН2О. При взаимодействии основных оксидов с водой образуются основные гидроксиды, или основания, а кислотных — кислотные гидроксиды, или кислоты. Имеются и бескислородные кислоты. Четких границ между кислотными и основными оксидами и гидроксидами нет, поскольку существует промежуточный слой — амфотерные соединения, проявляющие как кислотные, так и основные свойства.
|
|
Продуктами замещения ОН-групп в гидроксидах на анион кислотного остатка или замещения Н+ в кислотах на другие катионы являются соли. Бывают основные (не все ОН-группы замещены), кислые (не все Н+ замещены) и средние соли (в составе такой соли нет ни ОН-, ни Н+).
|
Принятие общих правил названия неорганических соединений упрощает процесс обмена научной и технической информацией между учеными-химиками, говорящими на разных языках, что способствует развитию химической науки.
|
ВАЖНЕЙШИМИ В ДАННОЙ КЛАССИФИКАЦИИ являются понятия кислот и оснований, поскольку взаимодействие между ними есть один из основных типов химических реакций. Добавление извести в кислые почвы, питье соды при изжоге — все это примеры кислотно-основных реакций. Известно большое число теорий кислот и оснований (см. «Кислоты и основания»). Согласно теории С. Аррениуса, основаниями называются электролиты, при диссоциации которых в качестве анионов в растворе существуют только гидроксид-анионы (ОН-):
NaOH → Na+ + ОН-.
Кислоты — это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
(Н+):НСL → Н+ + СL-.
Общие свойства оснований обусловлены наличием ОН-группы, а кислот — Н+. Продуктами взаимодействия любых кислот и оснований являются соли и вода. Это реакция нейтрализации, ее суть заключается в том, что при взаимодействии ионов Н+ и ОН- образуется вода: Н+ + ОН- = Н2О.
 |
 |
| Фантастические цветы из известнякового туфа. | Промышленные
сталагмиты и сталактиты образовали Пещеру со свечами. |
Однако границы между кислотами и основаниями размыты — существуют соединения, которые могут взаимодействовать и с кислотами, и с основаниями, — амфотерные гидроксиды:
АL(ОН)3 + ЗНСL = ALCL3 + ЗН2О,
АL(ОН)3 + NaOH = Na[AL(OH)4).
СОЛИ являются продуктом кислотно-основного взаимодействия, т. е. они образуются при взаимодействии кислот и оснований, кислотных оксидов с основными оксидами и гидроксидами и основных оксидов с кислотами. При хранении гидроксида калия КОН, например, на воздухе он поглощает диоксид углерода и превращается в карбонат — соль угольной кислоты:
2КОН + СО2 = К2СО3 + Н2О.
При термическом разложении солей образуются основной и кислотный оксиды. Примером служит обжиг известняка СаСО3:
СаСО3 = СаО + СО2.
В состав соли могут входить и комплексные частицы (см. «Комплексные соединения»). Простейшим комплексным катионом является ион аммония NH4+. Соли аммония по своим свойствам очень похожи на соли калия, так как радиусы ионов NH4+ и К+ близки. Бывают и более сложные комплексные катионы и анионы: [Ag(NH3)2]+, [SiF6]2-. Соли, образованные этими ионами, иногда называют «комплексными солями» ([Аg(NН3)2]СL, К2[SiF6]). Так называемые «двойные соли», например алюмокалиевые квасцы KAL(SО4)2 х 12H2O, и «смешанные соли», например белильная известь СаСLO2, относятся к группе средних солей.
 |
 |
| Сверкающие колонны сталагмитов. | Параллельный сросток кристаллов берилла. |
НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. Согласно разработанным правилам, в России приняты системы названий международной номенклатуры (МН) и русской номенклатуры (PH).
Названия важнейших бинарных соединений, согласно МН, образуются из латинского корня более электроотрицательного атома с суффиксом -ид и русского названия менее электроотрицательного атома в родительном падеже:
Кислород — оксиды, СаО — оксид кальция
Галоген — галогениды, КСL — хлорид калия
Азот — нитриды, BN — нитрид бора
Сера — сульфиды, CuS — сульфид меди
Углерод — карбиды, AL4C3 — карбид алюминия
Кремний — силициды, Мg2Si — силицид магния
Водород — гидриды, NaH — гидрид натрия.
Если менее электроотрицательный элемент может находиться в разных степенях окисления, то после его названия в скобках римскими цифрами указывается его степень окисления: SO2 — оксид серы (IV). Это правило справедливо и для названия гидроксидов и солей. Соединения, содержащие анион O22-, называют пероксидами: Н2О2 — пероксид водорода.
Согласно МН, соединения, содержащие в своем составе только анионы ОН-, называются гидроксидами: Fе(ОН)2 — гидроксид железа (II).
Для кислот применяется в основном PH, а для анионов — МН. Название кислородсодержащих кислот образуется от русского названия кислотообразующего элемента с добавлением определенного суффикса:
-ная, -овая для высшей степени окисления элемента (наибольшее содержание кислорода): HNO3 — азотная кислота; -истая, -оватая, -оватистая для низших степеней окисления элемента (в убывающем порядке): HNO3 — азотная, HNO2 — азотистая; HCLO4 — хлорная, HCLO3 — хлорноватая, HCLO2 — хлористая, HCLO — хлорноватистая.
Названия кислот, содержащих элемент в одной и той же степени окисления и представляющих собой различные гидратные формы, отличаются приставками: мета— с наименьшим числом молекул воды, орто- — с наибольшим: НРО3 — метафосфорная кислота, Н3РО4 — ортофосфорная кислота.
Для названия бескислородных кислот пользуются МН: оно образуется из названия элемента с окончанием -о и слова водородная (НСL — хлороводородная кислота, H2S — сероводородная кислота).
 |
 |
| Несмотря на то что кварц самый распространенный минерал на Земле, такие чистые кристаллы встречаются довольно редко. | В кристалле рутилированного кварца содержатся волокна рутила - источника титана. |
Для наименования солей в настоящее время принята МН. Название складывается из латинского названия аниона и названия металла в родительном падеже. В наименовании кислотного остатка кислородсодержащей кислоты присутствует суффикс -ат (при максимальной степени окисления кислотообразующего элемента) или -ит (при более низкой степени окисления) и -ид — для бескислородных кислот. Например, FeSО4 - сульфат железа (II), NaNО2 — нитрит натрия.
Названия кислых солей образуются добавлением приставки гидро-, а основных — гидроксо-. Например, К2НРО4 — гидрофосфат калия, (СuОН)2СО3 — гидроксокарбонат меди. Формулы и названия двойных солей начинаются с катиона, имеющего более высокую степень окисления: KAL(SО4)2 х 12H2O — двенадцативодный сульфат алюминия — калия. Ниже приведены некоторые технические и часто используемые названия некоторых неорганических веществ:
|
Название |
Химическая формула |
|
Нашатырный спирт |
NH3 (водный раствор) |
|
Бертолетова соль |
KCLO3 |
|
Бура |
Na2B4О7 х 10H2O |
|
Гипосульфит |
Na2S2O3 x 5Н2О |
|
Глауберова соль |
Na2SO4 x 10H2O |
|
Гипс |
CaSO4 x 2Н2О |
|
Глинозем |
AL2O3 |
|
Жавелевая вода, жавель |
КСLO + KCL (водный раствор) |
|
Жидкое стекло |
NA2SiO3, К2SiO3 |
|
Золото сусальное |
SnS2 |
|
Известковое молоко |
Са(ОН)2 в воде |
|
Известь белильная гашеная жженая (негашеная) натронная |
CaOCL2 Са(ОН)2 СаО 2СаО + NaOH |
|
Каломель |
Hg2CL2 |
|
Киноварь |
HgS |
|
Купорос железный |
FeSO4 x 7H2O |
Так же как химические вещества подразделяют на классы, так и химические реакции делят на различные типы. Одним из наиболее распространенных типов химических реакций являются окислительно-восстановительные процессы.
| Окислительно-восстановительные реакции лежат в основе очень многих процессов, используемых в технике, - это получение и очистка металлов, нанесение покрытий, электролитическое копирование гравированных пластин, химические источники тока. Так, в космических полетах наиболее эффективными оказались водородно-кислородные топливные элементы, в которых на одном из электродов происходит окисление водорода кислородом. Результатом такого процесса является вода, которую можно использовать в качестве питьевой. | ||
|
|
|
|
|
В случае контакта двух металлов возникает гальваническая пара, в которой окисляется более активный металл, при этом высвобождающиеся электроны переходят на менее активный металл, и там происходит процесс восстановления. |
||
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ. Химики наиболее часто пользуются следующей классификацией химических реакций неорганических соединений.
По тепловому эффекту реакции делятся на:
экзотермические (с выделением тепла), например: получение железа методом алюмотермии:
2АL + Fe2O3 = 2Fе + AL2O3
или горение метана:
СН4 + 2О2 = СО2 + 2Н2О;
эндотермические (с поглощением тепла), например:
реакция N2 + О2 = 2NO протекает только при температуре электрического разряда.
По полноте прохождения реакции:
обратимые, например:
N2 + ЗН2 ↔ 2NH3
или гидролиз солей:
Na2S + Н2О ↔ NaHS + NaOH;
необратимые, например: горение углерода:
С + О2 = СО2,
термическое разложение дихромата аммония:
(NН4)2Сг2О7 = N2 + Сr2О3 + 4Н2О.
По изменению степени окисления:
окислительно-восстановительные реакции, например: взаимодействие хлора со щелочью:
6КОН + 3CL2 = KCLO3 + 5КСL + 2Н2О
или получение иода из иодида калия:
2KI + CL2 = 2КСL + I2;
без изменения степени окисления, например: образование осадка хлорида серебра:
NaCl + AgNO3 = AgCL + NaNO3
или гидролиз сульфида алюминия:
AL2S3 + 6Н2О = 2АL(ОН)3 + 3H2S.
По типу взаимодействия:
реакции разложения (из одного вещества образуется два и более), например: термическое разложение основного карбоната меди (малахита):
(СuОН)2СО3 = 2СuО + СО2 + Н2О
или хлората калия (бертолетовой соли):
2KCLO3 = 2КСL + 3О2;
реакции соединения (из двух и более веществ образуется одно), например: синтез хлороводорода:
Н2 + CL2 = 2НСL
или образование солей из оксидов:
СаО + СО2 = СаСО3;
реакции замещения (простое вещество взаимодействует со сложным с образованием другого простого вещества), например: взаимодействие металлов с кислотами:
Zn + 2НСL = ZnCl2 + Н2
или вытеснение одним металлом другого из солей:
CuSO4 + Zn = Сu + ZnSО4;
реакции двойного обмена (два сложных вещества образуют два других сложных вещества). Реакции двойного обмена в растворах проходят практически до конца, если в результате реакции образуется газ:
Na2S + 2НСL = 2NaCL + Н2S↑,
осадок:
Рb(NО3)2 + 2KI = РbI2↓ + 2KNO3
или мало диссоциирующее вещество. Мало диссоциирующим веществом чаще всего является вода (реакция нейтрализации) или комплексное соединение, поскольку такой ион, как, например,
[Fe(CN)6]3-,
плохо диссоциирует:
FеСL3 + 6KCN = K3[Fe(CN)6] + ЗКСL.
Итак, реакции замещения всегда окислительно-восстановительные, в результате реакций разложения и соединения степень окисления может меняться или оставаться без изменения, а в реакциях двойного обмена степени окисления элементов не меняются.
|
|
|
|
Окислительно-восстановительная реакция в условиях лаборатории. |
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ являются одним из важнейших типов химических реакций. Это реакции, в которых происходит изменение степени окисления элементов, входящих в состав исходных веществ. Например, в реакции цинка с хлороводородной кислотой:

В процессе реакции один элемент принимает электроны, при этом его степень окисления снижается, а другой — отдает электроны, и его степень окисления повышается:
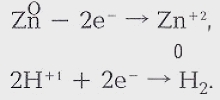
Не может быть реакции только окисления или только восстановления, так как в процессе реакции электроны переходят от одного атома к другому, например от Zn к Н, как в приведенной выше реакции. Окислительно-восстановительные реакции можно разделить на четыре типа:
1) межмолекулярные, когда элементы — окислитель и восстановитель — входят в состав разных веществ. Например, взаимодействие оксида серы (IV) с хлором в растворе:
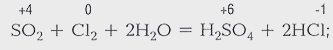
2) внутримолекулярные элементы — окислитель и восстановитель — разные, но входят в состав одного вещества. Например, термическое разложение дихромата аммония:
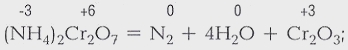
3) диспропорционирования, когда элемент — окислитель и восстановитель — один и тот же. Например, азот: реакция взаимодействия оксида азота (IV) с гидроксидом натрия:
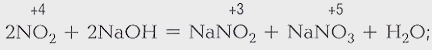
4) электролиз, когда окислитель и восстановитель представляют собой электроды. Например, электролиз водного раствора хлорида натрия:
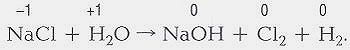
Процессы окисления-восстановления всегда взаимосвязаны, но в некоторых случаях их можно разделить в пространстве, и тогда мы получим гальванический элемент. Здесь электроны от восстановителя (Zn) переходят к окислителю Сu2+ по внешней электрической цепи, при этом происходит реакция:
Zn + CuSO4
= ZnS04 + Cu.
|
Схема гальванического элемента: |
КОЛИЧЕСТВЕННОЙ ХАРАКТЕРИСТИКОЙ способности веществ вступать в окислительно-восстановительные реакции является электродный потенциал. В случае данного гальванического элемента это разность потенциалов, возникающая на границе раздела металла и окружающей его жидкой фазы:
для меди (Сu2+ + 2е- = Сu) — это φCu,
для цинка (Zn2+ + 2е- = Zn) — это φZn.
Абсолютное значение электродного потенциала φ нельзя измерить непосредственно, однако можно измерить ЭДС в системе, состоящей из двух полуэлементов. Принято измерять электродные потенциалы относительно водородного полуэлемента (2Н+ + 2е- = Н2).
|
|
Стандартный электродный потенциал Е0 металла — это ЭДС гальванического элемента при условии, что один полуэлемент водородный
С(Н+) = 1 моль/л, р(Н) = 0,1 МПа, (Т = 25° С),
а второй — металл, погруженный в раствор его соли с концентрацией ионов металла 1 моль/л. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый ряд стандартных электродных потенциалов. С помощью Е0 можно предсказать многие свойства металлов: вытеснение металлов из солей, взаимодействие с кислотами, электролиз растворов солей. Чем больше электродный потенциал, тем сильнее окислитель.
Стандартные электродные потенциалы определены не только для металлов, но и для неметаллических систем, например:
CL2 + 2е- = 2СL-, NO3- + 4Н+ + Зе- = NO + 2Н2О.
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ, относящиеся к разным классам химических веществ, приведены в таблице.
Важнейшие окислители и восстановители
|
Окислители (+е-) |
Восстановители (-е-) |
|
1. Простые вещества: галогены (F2, CL2, Вг2, I2), усиление окислительной активности от I2 к F2; кислород (О2), озон (О3) |
1. Простые вещества: металлы; водород (Н2) и углерод (С) при нагревании |
|
2. Оксиды элементов с высокими степенями окисления, например: МnО2, СгО3, SO3, NO2, HgO |
2. Оксиды: СО, SO2 |
|
3. Кислоты, содержащие элементы с высокими степенями окисления (HNO3, H2SO4, HIO3 и др.). |
3. Бескислородные кислоты, содержащие элемент в отрицательной степени окисления (НCL, HF, НВг, H2S) |
|
4. Соли, содержащие элементы с высокой степенью окисления (КМnО4, К2Сr2О7, KCLO3 и др.) |
4. Водородные соединения: NH3, РН3, СН4 и др. |
| 5. Ионы металлов в высокой степени окисления или малоактивных металлов (Fe3+, Сu2+, Аg+), а также ион Н+ | 5. Ионы металлов в низших степенях окисления (Sn2+, Fe2+, Cr2+), а также гидрид-ион Н- |
| 6. Анод при электролизе | 6. Органические вещества (альдегиды, спирты, амины и др.) |
|
7. Катод при электролизе |
Существуют вещества, которые могут быть как окислителями, так и
восстановителями. Обычно они содержат элементы в промежуточной степени
окисления, например; пероксид водорода Н2О2
(степень окисления кислорода — 1), оксид серы (IV) SO2,
азотистая кислота HNO2 (степень окисления азота +З) и др.
В том случае, когда окислительно-восстановительная реакция протекает в растворе, важную роль играет кислотность среды, а величина показателя pH определяет формы существования продуктов реакции.
|
С помощью электролиза-электролитического рафинирования - можно проводить очистку меди. В этом процессе роль анода играет неочищенная медь, а чистая медь - роль катода. Примеси, присутствующие в исходной меди, оседают в виде анодного ила, который содержит драгоценные металлы, например золото и серебро. |
ЭЛЕКТРОЛИЗ — это процесс окисления-восстановления, протекающий при прохождении электрического тока через раствор или расплав электролита. На рисунке представлена схема электролитической ячейки. Различают электролиз расплава и электролиз водного раствора.
Электролиз расплава. В расплаве соли диссоциируют на ионы, например:
NаСL(ж) → Na+ + СL-.
На электродах происходят следующие реакции:
анод (+): 2СL- - 2е- = CL20;
катод (-): Na+ + е- = Na.
Полностью реакцию, протекающую при электролизе, можно записать так:
|
|
2NaCLpасплав = 2Na + CL2.
Электролиз водных растворов. Состав продуктов электролиза зависит как от природы ионов, так и от материала электродов.
На катоде: конечный продукт определяется положением металла в ряду стандартных электродных потенциалов.
На аноде:
а) на инертном аноде (Pt, С и др.) окисляются анионы бескислородных кислот СL-, Вг-, I-, S2- или кислород воды, если в растворе есть анионы NO3-, SO42-, PO43-;
б) при растворимом аноде (Сu, Аg, Ni, Zn) он растворяется, например:
Сuанод - 2e- → Сu2+p-p.
В зависимости от природы катиона и аниона можно выделить четыре типа растворов, в которых протекают процессы электролиза.
|
|
|
|
Очистка меди электродным рафинированием. |
Батарейки карманного фонарика - сухие элементы - являются химическими источниками тока. |
1. Соль состоит из катиона и аниона, которые разряжаются на электродах: CUCL2 + (Н2О) = Сu + CL2, при этом идут следующие реакции:
катод (-): Сu2+ + 2е- = СuО;
анод (+): 2Сl- - 2е- = CL2.
В результате электролиза концентрация соли уменьшается.
2. В состав соли входит катион, разряжающийся на катоде, и анион кислородсодержащей кислоты, и поэтому на аноде происходит разложение воды:
2CuSO4 + 2Н2О = 2Сu + О2 + 2H2SO4.
На электродах протекают следующие реакции:
катод (-): Сu2+ + 2е- = СuО;
анод (+): 2Н20 - 4е- = О2 + 4Н+.
В результате электролиза меняется состав раствора, и в анодном пространстве появляется серная кислота.
3. В состав соли входит катион, который не разряжается на катоде, поэтому на катоде происходит разложение воды; анион соли разряжается на аноде:
2NaCL + 2Н2О = 2NaOH + CL2 + Н2.
На электродах протекают следующие реакции:
катод (-): 2Н2О + 2е- = Н2 + 2ОН-;
анод(+): 2СL- - 2е- = CL2.
В ходе электролиза изменяется и состав раствора — в катодном пространстве образуется щелочь.
4. И наконец, соль состоит из аниона и катиона, не разряжающихся на электродах:
Na2SО4 + 2Н2О = Na2SО4 + 2Н2 + О2.
В этом случае электролизу подвергаются только молекулы воды, а концентрация соли в растворе увеличивается:
катод (-): 2Н2О + 2е- = Н2 + 2ОН-;
анод(+): 2Н2О - 4е- = О2 + 4Н+.
Взаимосвязь между количеством
вещества, образовавшегося при электролизе, и количеством электричества,
прошедшего через электрическую ячейку, определяется законом Фарадея. Еще два
важных аспекта, тесно связанные с окислительно-восстановительными процессами, —
химические источники тока и коррозия.
Растворы играют огромную роль в химии. Почти все реакции, с которыми приходится иметь дело, протекают в растворах, причем в большинстве случаев водных. Жидкая фаза — довольно удобная среда для осуществления реакций. Молекулы в растворах достаточно подвижны и в то же время занимают ограниченный объем.
|
К твердым растворам, в частности, относятся сплавы. Металлы медь, серебро и золото иногда в зарубежной литературе называют монетными, так как из сплавов на их основе чеканят монеты. Так, в СССР монеты достоинством до 5 коп. содержали 95% Сu и 5% АL, а от 10 коп. - 80% Сu и 10% Ni. Международные золотые и серебряные монеты делают из сплава 90% Аu(Аg) и 10% Сu.
|
РАСТВОР — это гомогенная (однородная) система переменного состава. Растворы включают в себя растворитель, растворенное вещество (одно или несколько) и продукты взаимодействия; количественные соотношения между растворенными веществами и растворителями могут быть самыми различными. Обычно растворителем считают тот компонент, которого больше. Классификацию растворов можно проводить по разным признакам; агрегатному состоянию растворителя и растворенного вещества, размерам растворенных частиц, концентрации растворенных частиц (насыщенные, ненасыщенные и пересыщенные растворы).
|
|
Как видно из приведенных примеров, жидким растворителем может быть не только вода, но и другие жидкости: серная кислота, спирты, а также эфиры, бензол, жидкий аммиак и т. д.
Системы «растворитель — растворенное вещество», в зависимости от размеров частиц растворенного вещества, подразделяют на истинные (молекулярные) растворы, коллоидные растворы и механические смеси. Коллоидные частицы, так же как и компоненты истинного раствора, нельзя отделить фильтрованием или центрифугированием. Однако они настолько велики, что рассеивают свет, проходящий через коллоидный раствор (эффект Тиндаля).
|
|
|
|
Классификация растворов по размерам частиц. |
При растворении нитрата аммония теплота поглощается, процесс эндотермический. |
Здесь рассматриваются свойства только истинных водных растворов.
Растворение — это физико-химический процесс. При растворении в воде твердой соли, например NaCL, одновременно происходят разрушение кристаллической решетки NaCL, диффузия растворенных веществ (физические процессы) и взаимодействие растворителя и растворенного вещества с образованием новых химических веществ — Na+ х aq, СL- х aq (химические процессы). Если растворитель — вода, продукты взаимодействия называются гидратами, в других случаях — сольватами. Доказательством того, что растворение — это не только физическое смешение веществ, служат такие экспериментальные факты, как:
наличие тепловых эффектов, изменение объема и изменение окраски.
Существование кристаллогидратов. Гидраты различаются по составу и устойчивости. Например, в водном растворе NaCL образуются неустойчивые гидраты переменного состава Na+ х aq и СL- х aq. При выпаривании такого раствора гидраты разрушаются и получаются кристаллы NaCL. В водном растворе CUSO4 образуются гидраты [Cu(H2О)6]2+ и SO42- х aq. Из такого раствора выделяются кристаллы, содержащие молекулы воды в своем составе CuSO4 х 5Н2О. Их цвет соответствует цвету раствора — голубой, тогда как исходный CuSO4 — бесцветный. Гидратная вода в этом случае настолько прочно связана с катионами меди, что входит в состав кристалла медного купороса. Такие вещества (например, CuSO4 х 5Н2О) называют кристаллогидратами. Воду, входящую в состав кристаллогидрата, называют кристаллизационной.
|
|
|
|
При растворении сульфата меди теплота выделяется, процесс экзотермический. |
Растворимость газов всегда увеличивается при повышении давления и понижении температуры. Газированные напитки, в том числе пиво и шампанское, хранят под давлением. Открывая бутылки в теплом помещении, можно лишиться всего содержимого, так как начинается бурное выделение газа, растворимость которого резко уменьшается. |
РАСТВОРЫ НАСЫЩЕННЫЕ, НЕНАСЫЩЕННЫЕ И ПЕРЕСЫЩЕННЫЕ. При растворении одних веществ, например этилового спирта С2Н5ОН, в воде можно приготовить раствор любой концентрации — от 0 до 100%, т. е. взаимная растворимость этих веществ неограниченная. При растворении других веществ, например хлорида натрия NaCL, растворимость ограниченная. Больше чем 36 г NaCL в 100 г воды (при 20° С) не растворится. В этом случае получится равновесная смесь твердого осадка NaCL и раствора:
NaCL(ТВ) + aq → NaCL(p-p).
Раствор, находящийся в равновесии с твердым растворяемым веществом, называется насыщенным. Концентрация насыщенного раствора — величина постоянная при данной температуре для данной системы. При изменении температуры количество вещества, которое может раствориться, изменяется.
На рисунке изображена зависимость концентрации насыщенных растворов от температуры для различных солей — так называемые кривые растворимости.
Концентрацию насыщенного раствора — растворимость Р — обычно выражают в граммах растворенного вещества в 100 г воды. При растворении газов в воде на растворимость влияет не только температура, но и давление. Таким образом, термин растворимость имеет двойное значение:
1) способность вещества растворяться в данном растворителе;
2) концентрация насыщенного раствора.
Газированные напитки, в том числе пиво и шампанское, хранят под давлением. Открывая бутылки в теплом помещении, можно лишиться всего содержимого, так как начинается бурное выделение газа, растворимость которого резко уменьшается. В растворе, концентрация которого меньше концентрации насыщенного раствора, можно дополнительно растворить некоторое количество вещества. Такой раствор называют ненасыщенным.
Пересыщенный — раствор, в котором содержится вещества больше, чем в насыщенном растворе. Для пересыщенного раствора характерно неустойчивое состояние, при малейшем изменении внешних условий (перемешивании, встряхивании, попадании кристаллика соли или пылинок) происходит самопроизвольная кристаллизация избыточной соли, и раствор становится насыщенным (он находится в равновесии с закристаллизовавшимся осадком).
Количественной характеристикой растворимости труднорастворимых веществ является произведение растворимости (Пр) — произведение концентраций ионов в насыщенном растворе сильного электролита.
|
Кривые растворимости позволяют наглядно представить и количественно рассчитать, что происходит при охлаждении раствора, насыщенного при температуре Т1 и охлажденного до Т2. m1 - масса соли, растворенной в 100 г воды при T1 (исходный раствор), m2 - масса соли, растворенной в 100 г воды при Т2 (раствор после охлаждения), m1 - m2 - масса закристаллизовавшейся при охлаждении соли.
1 - водный раствор иода: |
Получить пересыщенный раствор, например CUSO4, можно очень осторожным охлаждением раствора, насыщенного при более высокой температуре и отфильтрованного от твердой соли.
Растворимость различных веществ в воде различается очень сильно. Так, карбоната кальция в 100 г воды может раствориться лишь 0,00013 г. Способность веществ к растворению зависит от природы растворенного вещества (характера связи, прочности кристаллической решетки) и от природы растворителя (полярности его молекул, диэлектрической проницаемости).
Например, в воде — полярном растворителе с большой диэлектрической проницаемостью — хорошо растворимы вещества с ионной и полярной связью, а в неполярных растворителях (таких, как бензол) — вещества с неполярной связью (например, I2).
Растворимость иода в CCL4 в 85 раз больше, чем в воде. Распределение растворенного иода между двумя несмешивающимися растворителями определяется константой равновесия:
Эта величина называется коэффициентом распределения, который не зависит от концентрации, что часто используется для разделения и очистки веществ методом экстракции.
Растворимость большинства веществ в воде ограниченна. Следует различать насыщенный и концентрированный растворы.
В отличие от насыщенного концентрированный раствор — понятие относительное. Концентрированный раствор содержит много растворенного вещества, а разбавленный мало, но точно сказать, до какой концентрации считается раствор разбавленным, нельзя.
Так, в
приведенном выше примере насыщенный раствор
карбоната кальция — очень разбавленный, а
ненасыщенный раствор, например, серной кислоты
может быть очень концентрированным (до 98%).
В растворах некоторые вещества распадаются на ионы.
Химические реакции в растворах являются совокупностью реакций всех ионов и молекул этого раствора. Свойства раствора отличаются от свойств исходных растворителя и растворенного вещества, в частности, может измениться его электропроводность. Так, при растворении в воде ионного кристалла NaCL получается раствор, проводящий электрический ток, тогда как чистая вода и твердый NaCL практически неэлектропроводны. В то же время при растворении глюкозы в воде образовавшийся раствор электрический ток не проводит.
|
Гидратированные ионы в растворе. |
Вещества, растворы и расплавы которых проводят электрический ток, называются электролитами. Вещества, которые в аналогичных условиях не проводят электрический ток, называются неэлектролитами. Следовательно, NaCL — электролит, а глюкоза — неэлектролит. Электропроводность растворов и расплавов обусловлена перемещением ионов (проводники второго рода), в то время как электропроводность металлов связана с наличием и перемещением свободных электронов — проводники первого рода. Ионы в электролитах либо уже находятся в кристаллической решетке ионных соединений (NaCL), либо образуются при растворении веществ с полярной ковалентной связью (НСL). И в том, и в другом случаях переносчиком заряда в растворах являются сольватированные ионы. Деление на электролиты и неэлектролиты несколько условно, так как одни и те же вещества в зависимости от растворителя могут образовывать растворы, проводящие и не проводящие электрический ток. Например, раствор хлороводорода НСL в воде — электролит, а в бензоле С6Н6 — неэлектролит.
Процесс, при котором соединения с ионной или ковалентной полярной связью в полярных растворителях распадаются с образованием ионов, называется электролитической диссоциацией.
Образовавшиеся при электролитической диссоциации ионы, носители положительных и отрицательных зарядов, могут перемещаться в электрическом поле. Таким образом, раствор становится электропроводным. Противоположно заряженные ионы могут взаимодействовать и между собой, образуя исходные незаряженные молекулы — процесс ассоциации. Ассоциированные и диссоциированные частицы находятся в равновесии.
Подобные процессы диссоциации и ассоциации происходят и в расплавах при высоких температурах, но уже не под влиянием полярного растворителя, а за счет увеличения теплового движения. Энергии, сообщенной веществу при нагревании, достаточно для разрыва химической связи и образования ионов. Например, NaCL является электролитом и в расплаве, и в водном растворе.
Основные положенргя теории электролитической диссоциации (впервые предложенные С. Аррениусом в 1887 г., затем в них были внесены определенные уточнения, в соответствии с учением о строении атома и химической связи) можно сформулировать так:
• электролиты при растворении в полярных растворителях (или в расплавах) распадаются на положительные и отрицательные ионы — диссоциируют. В целом раствор (расплав) остается электронейтральным;
• в электрическом поле ионы перемещаются в соответствующем направлении: ионы, несущие положительный заряд (катионы), двигаются к катоду, а ионы, несущие отрицательный заряд (анионы), — к аноду;
• электролитическая диссоциация — процесс обратимый.
|
Индикаторы. Некоторые вещества могут обратимо изменять свою окраску в зависимости от кислотности среды (величины показателя pH), в которой они находятся. Такие вещества называются кислотно-основными индикаторами. Обычно это слабые органические кислоты, у которых окраска молекулярной и анионной формы различается. Например, лакмус - это слабая кислота (условно представим его формулой HL), в растворе которой происходит диссоциация: HL → Н+ + L-. Красный Синий В кислой среде (при избытке ионов водорода) равновесие смещается в сторону недиссоциирован-ных молекул, и окраска раствора красная. В щелочной среде (при избытке гидроксидных ионов) ионы Н+ связываются - образуется вода, равновесие смещается вправо, в сторону образования анионов, и раствор приобретает синюю окраску. Изменение окраски происходит в интервале pH от 6 до 8. Различные индикаторы меняют окраску в разном диапазоне pH. |
|||
 |
 |
 |
 |
ОСНОВНЫМИ КОЛИЧЕСТВЕННЫМИ ХАРАКТЕРИСТИКАМИ электролитической диссоциации являются степень диссоциации α и константа диссоциации Кд (для слабых электролитов).
Степень диссоциации — это отношение количества распавшихся на ионы частиц к общему количеству растворенных частиц. Она может изменяться от 0 до 1 (от 0 до 100%) и измеряется экспериментально.
В зависимости от величины α электролиты разделяют на три группы:
α < 3% Слабые
3% < α < 30% Средней силы
α > 30% Сильные
Понятия «кислота» и «основание» включают в себя целый комплекс особенностей, поэтому точное их определение до сих пор не найдено и служит предметом постоянной дискуссии.
 |
 |
| Привычный кислотный продукт. | |
СУЩЕСТВУЕТ МНОГО ТЕОРИЙ, по-разному определяющих эти понятия. Основные определения кислот и оснований приведены в таблице.
| Основные определения кислот и оснований | ||
| Теория | Кислота | Основание |
| Аррениуса (1880) | Поставляет в раствор ионы H+(HN03 и др.) | Поставляет в раствор ионы OH- (NaOH и др.) |
| Бренстеда-Лаури (1923) | Донор протонов (NH+4, НСL, [Сu(Н20)4]2+) | Акцептор протонов (NH3, ОН-, РO43- и др.) |
| Лукса-Флуда (реакции в расплаве) | Акцепторы оксид-ионов (SiO2) | Доноры оксид-ионов (СаО) |
| Сольво-систем | Повышает концентрацию катионов растворителя (SbF5 + ВгF3 ↔ SbF6- + BrF2+) | Повышает концентрацию анионов растворителя (ВгF3 + КF x ВгF4- + К+) |
| Льюиса (1923) | Акцептор электронной пары (ВF3, Аg+ и др.) | Доноры электронной пары (NH3, F- и др.) |
| Усановича (1939) | Донор катиона (в том числе Н+) или акцептор аниона (в том числе электронной пары) | Донор аниона (в том числе электронной пары) или акцептор катиона (в том числе Н+) |
Различие этих концепций не в том, какая из них «правильная», а в том, насколько она подходит к данным условиям. Согласно определению Аррениуса, кислота представляет собой вещество, повышающее концентрацию ионов водорода в водном растворе, а основание — вещество, повышающее концентрацию гидроксидных ионов. Более общее определение кислот и оснований, предложенное в 1923 г. Бренстедом и Лаури, применимо не только к водным растворам, но и ко всем системам, которые содержат вещества, имеющие в своем составе водородные ионы. Теорию Бренстеда — Лаури иногда называют еще протолитической теорией, поскольку в ней кислотно-основные взаимодействия рассматриваются как реакции, в которых происходит «борьба» за протон. Важно понимать, что протон H+ не может существовать в растворе как таковой. Диаметр протона очень мал (10-15 м), и электрическое поле вблизи него столь велико, что он притягивает любые молекулы, содержащие неподеленные электронные пары. Например, в водном растворе существует ион гидроксония (Н3О+), образованный по реакции Н+ + Н2О = Н3О+. Эта реакция сопровождается выделением энергии в 1300 кДж/моль, что подтверждает невозможность присутствия негидратированного протона. В неводных растворителях протон также присутствует в виде сложных ионов:
в аммиаке — NH4+,
в этаноле — С2Н5ОН2+.
По Бренстеду — Лаури, кислота — это вещество, которое может передать протон другому веществу, а основание — вещество, способное принять протон от другого вещества.
 |
 |
| Минеральная вода «Боржоми» «снижает» кислотность. | Лимонная кислота. |
Согласно этой теории, кислотами и основаниями могут быть как нейтральные частицы, так и ионы. Например, уксусная кислота отдает протон, значит, она — кислота:
СН3СООН → СН3СОО- + Н+.
В свою очередь, ацетат-ион может принимать протон и образовывать снова уксусную кислоту:
СН3СОО- + Н+ → СН3СООН.
Следовательно, ацетат-ион — основание, но основание, сопряженное уксусной кислоте. Каждой кислоте соответствует сопряженное основание:
Кислота ↔ Основание + Н+.
|
Сопряженная кислота |
|
Сопряженное основание |
| HCL |
↔ |
CL- + H+ |
| H2SO4 | ↔ | HSO4- + H+ |
| HSO4- | ↔ | SO42- + H+ |
| NH4+ | ↔ | NH3 + H+ |
| H2O | ↔ | OH- + H+ |
| H3O+ | ↔ | H2O + H+ |
Подобные пары называются сопряженными парами кислот и оснований.
Но эти соотношения не отражают истинного положения вещей, так как
протон не может существовать сам по себе. В действительности кислотно-основная
реакция — это реакция между двумя парами сопряженных кислот и оснований,
в которых протон переходит от кислоты одной пары к основанию другой. Например, в
водном растворе кислота НСL отдает протон воде,
которая играет роль основания:
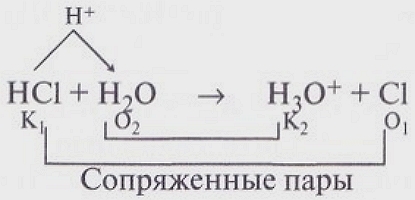
Ниже приведены примеры различных реакций в интерпретации теории Бренстеда — Лаури:
|
Кислота-1 + основание-2 |
|
Сопраженные основание-1 + кислота-2 |
|
HCL + NH3 |
↔ |
CL- + NH4- |
|
HCL + CO3 |
↔ |
CL- + HCO3- |
|
NH3 + H2O |
↔ |
OH- + NH4+ |
|
CO3 + H2O |
↔ |
OH- + HCO3- |
Как видно из этих примеров, в водной среде теория Бренстеда — Лаури не противоречит представлениям Аррениуса: кислоты увеличивают концентрацию ионов гидроксония (протонов) в растворе, как НСL, например, а основания — ионов гидроксила, как аммиак NH3. Вода в различных реакциях может выступать и как донор протонов, и как акцептор, — это амфотерное вещество.
|
Многие реакции, которые можно отнести к кислотно-основным равновесиям, проходят в апротонных растворителях - жидком SO2, SOCL2, ВгF3 и др. Эти вещества в жидком состоянии частично диссоциируют, например: 2ВгF3 ↔ ВгF4+ + ВгF4. Согласно теории сольвосистем, кислота есть растворимое вещество, которое при диссоциации или в результате взаимодействия с растворителем образует катион, характерный для растворителя. Основанием называют вещество, которое в подобных случаях образует анион, характерный для растворителя. Например, пентафторид сурьмы является кислотой, при растворении SbF5 в ВгF3 происходит реакция: SbF5 + ВгFз ↔ SbF6- + ВгF2+, а основанием является CsP: CsF + ВгFз ↔ Сs+ + ВгF4-. |
Теория кислот и оснований Бренстеда — Лаури позволяет количественно определить силу кислот и оснований и описывать равновесия в растворах, используя константы кислотности Kα. Сила кислоты — способность ее отдавать протон — характеризуется константой кислотности, т. е. константой равновесия реакции: НА ↔ Н+ + А-. Сильной кислоте всегда соответствует слабое сопряженное основание.
Протолитическая теория Бренстеда — Лаури позволяет рассматривать процесс гидролиза солей как частный случай кислотно-основного равновесия. Напомним, что под гидролизом солей понимают обменное взаимодействие ионов соли с водой, в результате которого происходило изменение показателя pH среды. Обычно гидролизу подвергаются соли, образованные анионами слабых кислот или катионами слабых оснований (по Аррениусу).
Гидролиз по аниону выражается уравнением типа:
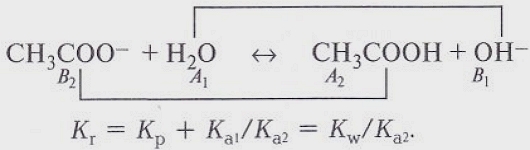
Гидролиз по катиону выражается уравнением типа:

В данном случае константа гидролиза — это константа кислотности сопряженной кислоты [Fе(Н2O)б]3+. На основании этих уравнений можно сделать следующие выводы:
• чем слабее кислота, тем сильнее гидролиз по аниону, чем слабее основание, тем сильнее гидролиз по катиону;
• равновесие гидролиза почти всегда смещено влево: Kr << 1 (исключение составляют случаи, когда соли гидролизуются и по катиону, и по аниону, например AL2S3);
• определить наличие гидролиза можно по изменению величины показателя pH раствора.
 |
 |
 |
Гидролиз усиливается при разбавлении, нагревании или добавлении веществ, связывающих ионы ОН- (или Н3О-). Например, при взаимодействии растворов хлорида алюминия и карбоната натрия происходит взаимное усиление гидролиза, и реакция идет до конца:
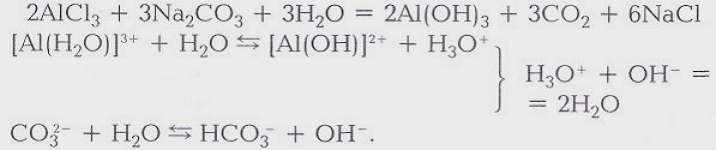
Все кислоты, имеющие Ka > Kа(Н3О+), т. е. более сильные, чем Н3О+, в водном растворе будут сильными кислотами. Для них реакции типа
НА + Н2О = Н3О+ + А-
идут практически до конца (K >> 1), и кислотные свойства таких растворов определяются исключительно свойствами Н3О+. Например, ни один эксперимент, проводимый в водном растворе, не позволит определить, какая из кислот, НВг или HI, является более сильной. Точно так же свойства всех сильных оснований определяются свойствами ионов ОН-, поскольку сильное основание полностью протонируется водой, например:
KNH2(тв) + Н2О(ж) = К+(р-р) + ОН-(р-р) + NН3(р-р).
Говорят, что по отношению к кислотам более сильным, чем Н3О+, и основаниям, более сильным, чем ОН-, вода оказывает нивелирующее действие, т. е. свойства таких растворов определяются поведением Н3О+ или ОН-.
Сила или слабость кислоты определяется тем растворителем, в котором она находится. Если НСL в воде является сильной кислотой и реакция с растворителем идет практически до конца:
НСL + Н2О → Н3О+ + СL-,
то в среде уксусной кислоты НСL — слабая кислота и реакция обратима:
НСL + СН3СООН ↔ СН3СООН+2
+ СL-.
Аналитическая химия включает в себя два основных направления — определение качественного состава (из каких элементов или групп элементов — ионов — состоит данный объект) и количественного состава (в каких соотношениях эти элементы находятся).
Наука, разрабатывающая методы анализа химических соединений, называется аналитической химией. В основе определения состава лежат различные химические (химические методы анализа) и физические свойства (физико-химические методы анализа) соединений. Кроме того, очень важную роль в аналитической химии играет точность определения содержания тех или иных веществ. В данном разделе будут кратко рассмотрены только основы химического анализа. Не вдаваясь в тонкости аналитической химии, рассмотрим главные принципы, лежащие в основе качественного химического анализа. Все химические реакции, используемые для определения состава неорганических соединений, часто подразделяют на анализ катионов (ионов металлов, входящих в состав вещества) и анализ анионов.
|
Малые количества вещества часто определяют с помощью микрокристаллических реакций. На стеклышко микроскопа наносят каплю анализируемого вещества и реагента. Идентификацию проводят по форме кристалликов осадка. Кристаллы МgNН4РО4, образующиеся при быстрой кристаллизации. |
ОПРЕДЕЛЕНИЕ АНИОНОВ. Рассмотрим последовательность операций при анализе анионов; предположим, на примере определения состава смеси четырех солей натрия: сульфита Nа2SOз, карбоната Na2CO3, хлорида NaCL и иодида Nal. Во-первых, надо растворить смесь в воде (возможно, в ней есть нерастворимые соли, и смесь, таким образом, можно уже частично разделить, упростив дальнейший анализ). В данном случае все соли хорошо растворимы в воде. Во-вторых, надо подобрать реактив, избирательно реагирующий с одним или определенным числом веществ. В нашем опыте с кислотой возможна реакция сульфита и карбоната натрия, в обоих случаях выделится газ:
Na2SO3 + H2SO4 = Na2SO4 + SО2↑ + Н2О;
На2СОз + H2SO4 = Na2SO4 + СО2↑ + Н2О.
Оба газа образуют нерастворимые соли с гидроксидами бария и кальция. Их можно дифференцировать на основе их окислительно-восстановительных свойств — оксид серы (IV) может быть восстановителем, а оксид углерода (IV) — нет. При пропускании смеси газов через подкисленный раствор перманганата калия он обесцветится, а SO2 поглотится:
5SO2 + 2КМnО4 + 2Н2О = 2MnSO4 + K2SO4 + 2H2SO4.
В аналитической химии стараются использовать те реакции, в которых изменяется цвет реагентов. Поэтому для доказательства восстановительных свойств часто применяют реакцию с перманганатом калия, так как при этом происходит резкое изменение окраски раствора — от интенсивно фиолетового до бесцветного. Это достаточно чувствительная реакция, т. е. позволяет определять малые количества вещества.
|
Титрование |
Для подтверждения того, что оставшимся газом является оксид углерода (IV), можно провести реакцию его с раствором гидроксида кальция. В результате выделится нерастворимый в воде карбонат кальция, и раствор помутнеет:
Са(ОН)2 + СО2 = CaCO3↓ + Н2О.
С целью определения в исходной смеси хлорида и иодида натрия можно воспользоваться реакцией взаимодействия их с нитратом серебра — с образованием нерастворимых в кислотах осадков (использовать этот реагент важно только после подкисления, поскольку карбонат и сульфит серебра также нерастворимы в воде):
NaCI + АgNОз = AgCL↓ + NaNO3,
Nal + АgNО3 = АgI↓ + NaNО3.
Хлорид серебра белый, а иодид желтоватый осадок, но в данном случае они выпали вместе, и иодид мешает определению хлорида. Смесь осадков поместим в раствор аммиака — иодид серебра в нем нерастворим, а затем вновь осадим AgCL, подкислив раствор:
AgCL + 2NH3 = [Аg(NН3)2]СL,
[Ag(NH3)2]CL + 2HNO3 = AgCL↓ + 2NH4NO3.
Таким образом, состав смеси доказан. Следует подчеркнуть, что это только одна из возможных схем проведения анализа. Для определения компонентов можно применить и другие реагенты.
ОПРЕДЕЛЕНИЕ КАТИОНОВ. В зависимости от особенностей взаимодействия катионов с кислотами и основаниями их можно разделить на несколько групп. Пример такой классификации приведен в таблице.
|
Кислотно-основная классификация катионов
|
||
|
№ аналитической группы |
Групповой реагент |
Катионы |
|
I |
HCL |
Аg+, Нg22+, РЬ2+ и другие катионы, хлориды которых малорастворимы в воде |
|
II |
H2SO4 |
Са2+, Sr2+, Ва2+ и другие катионы, сульфаты которых малорастворимы в воде |
|
III |
NaOH |
Zn2+, АL3+, Сг3+, Sn2+ и другие катионы, гидроксиды которых растворимы в щелочах |
|
IV |
NaOH |
Мg2+, Мn2+, Fe2+, Fe3+, Bi3+ и другие катионы, гидроксиды которых нерастворимы в разбавленных растворах щелочей |
|
V |
NH3 x Н2О |
Сu2+, Нg2+, Сd2+, Со2+, Ni2+ и другие катионы, гидроксиды которых растворимы в избытке аммиака с образованием аммиачных комплексов |
|
VI |
Нет |
К+, Na+, NH4+ и другие катионы, соли и гидроксиды которых хорошо растворимы в воде |
Определение катионов, таким образом, сводится к следующим этапам:
1) перевод анализируемой пробы в раствор;
2) предварительные испытания на определение катионов (см. табл.);
3) систематический качественный анализ катионов.
Для систематического анализа катионов применяют характерные реакции. Например, анализ на щелочные металлы основан на изменении окраски пламени. Так, натрий окрашивает пламя в желтый цвет, калий — в фиолетовый, а литий — в красный.
Характерными реакциями на ионы железа (Fe2+ и Fe3+) являются их реакции с гексацианоферратом (III) и гексацианоферратом (II) калия соответственно. При этом образуются синие осадки состава KFe[Fe(CN)6], которые содержат как ионы Fe2+, так и Fe3+:
FeCL2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCL,
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCL.
Для ионов многих металлов характерным является цвет нерастворимых в воде сульфидов. Раньше даже существовал метод классификации катионов по свойствам их сульфидов.
Ион аммония можно определить следующим образом. При действии щелочи на соли аммония выделяется газ, окрашивающий лакмусовую бумагу в синий цвет:
NH4CL + NaOH = NH3↑ + NaCL + Н2О.
В настоящее время широко используются спектральные методы анализа, основанные на поглощении или излучении атомами характерных спектров при взаимодействии их с различными типами излучений.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ. Для определения количественного состава анализируемых веществ существует два основных химических метода анализа — титриметрический и гравиметрический.
Суть титриметрического анализа заключается в измерении объема израсходованного на реакцию реактива точно известной концентрации.
|
Основные методы титриметрического анализа |
||
|
Метод анализа |
Тип химической реакции |
Титранты |
|
Кислотно-основное титрование |
Нейтрализация |
Кислоты (НСL и др.) Щелочи (NаОН и др.) |
|
Окислительно-восстановительное титрование(оксидиметрия) |
Окисление-восстановление |
КМnО4,I2, Nа2S2Оз |
|
Комплексонометрия |
Комплексонометрия |
Лиганды ЭДТА и др. |
По типу химических реакций, лежащих в основе этого анализа, его подразделяют на три основные группы, характеристики которых приведены в таблице.
Гравиметрический метод основан на измерении массы определяемого вещества или его составных частей, выделенных в виде соединений.
|
|
|
|
Систематический анализ катионов осуществляют с помощью характерных реакций. |
Гравиметрический метод основан на измерении массы определенного вещества или его составных частей, выделенных в виде соединений. |
Важной характеристикой каждого метода кроме чувствительности и
избирательности,
уже упомянутых в качественном анализе, является точность анализа. Обычно в титриметрических методах чувствительность составляет порядка
10-4 моль/л, а
относительная точность — 0,2%, для гравиметрических — чувствительность порядка 10-5
моль/л, точность — 0,05%.
С помощью теоретических основ химии можно описать наиболее общие свойства и способы получения соединений химических элементов. В качестве примера выберем химию хлора и железа.
 |
 |
| Молекула простого вещества хлора должна состоять из двух атомов: СL2. Это вещество - сильнейший окислитель, поэтому может взаимодействовать с простыми и сложными веществами. | |
ХЛОР находится в VII группе 3-го периода Периодической таблицы и относится к группе галогенов. На основании его положения в Периодической системе и электронного строения (валентные электроны 3s23p5) можно сделать вывод о том, что это очень электроотрицательный элемент (уступает только фтору, кислороду и азоту) и его основная степень окисления должна быть — 1. Действительно, в природе хлор встречается только в виде хлоридов: NaCL — каменная соль, NaCL x КСL — сильвинит, КСL х MgCL2 х 6Н2О — карналлит. Молекула простого вещества хлора должна состоять из двух атомов: CL2 (каждый атом имеет одну орбиталь с неспаренным электроном, которая при перекрывании с такой же орбиталью другого атома образует неполярную ковалентную связь), Это вещество — сильнейший окислитель, поэтому может взаимодействовать с простыми и сложными веществами:
с металлами: 2Fe + 3CL2 = 2FеСL3,
с неметаллами: 2Р + 5CL2 = 2PCL5,
со сложными веществами: SO2 + 2Н2О + CL2 = 2НСL + H2SO4.
По тем же причинам получить хлор из природных соединений можно либо электролизом хлоридов, либо окислением хлороводорода более сильными окислителями, чем хлор, такими как КМnО4, МnО2, KCLO3, К2Сr2О7:
2КМnО4 + 16НСL = 5CL2 + 2КСL + 2MnCL2 + 8Н2О.
Наиболее важным соединением хлора со степенью окисления — 1 является хлороводород НСL. Атомы Н и СL в нем связаны полярной ковалентной связью. В стандартных условиях (комнатная температура и атмосферное давление) НСL — газ, который очень хорошо растворим в воде. В растворе молекулы НСL полностью диссоциируют на ионы — это сильная кислота. Как кислота НСL взаимодействует:
с металлами, стоящими в ряду стандартных электродных потенциалов левее водорода: Fe + 2НСL = FeCL2 + Н2
с основаниями АL(ОН)3 + ЗНСL = ALCL3 + ЗН2О
с основными оксидами СаО + 2НСL = CaCL2 + Н2О
с солями Nа2СО3 + 2НСL = 2NaCL + СО2↑ + Н2О
АgNО3 + НСL = АgСL↓ + HNO3
(качественная реакция на хлорид-ион)
Получают НСL либо синтезом из элементов, либо взаимодействием твердого хлорида натрия с концентрированной серной кислотой:
NaCL(TB) + Н2SO4(конц) = НСL↑ + NaHSO4.
Так как хлор менее электроотрицателен, чем кислород, фтор и азот, то в соединениях с ними он имеет положительные степени окисления.
|
Более активный металл вытесняет менее активный из солей. |
ЖЕЛЕЗО относится к d-элементам и находится в VIII группе 4-го периода Периодической таблицы элементов. Строение его внешней электронной оболочки 3d64s2. Как все d-элементы, железо проявляет несколько степеней окисления: +2, +3, +6. Наиболее устойчивые степени окисления +2 и +З. Это металл средней химической активности — стоит в ряду стандартных электродных потенциалов между цинком и никелем; при взаимодействии с кислотами-неокислителями выделяет водород и переходит в состояние окисления +2:
Fe + 2НСL = FeCL2 + Н2.
Из солей железо вытесняет менее активные металлы:
CuSO4 + Fe = FeSO4 + Сu.
При взаимодействии с сильными окислителями железо переходит в соединения со степенью окисления +3:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2Н2О.
Получают железо восстановлением оксидов углем, оксидом углерода (промышленный метод) либо алюминием (алюмотермия).
При увеличении степени окисления усиливаются кислотные свойства гидроксидов железа. Fe(OH)2 — основной гидроксид, Fe(ОН)3 — амфотерный, а при степени окисления +6 — кислотный, образующий соли типа K2FeО4.
С точки зрения окислительно-восстановительных процессов соединения Fe (II) обладают восстановительными свойствами, Fe (III) — слабые окислители, а Fe (VI) — очень сильные окислители, они окисляют воду в кислой среде.
Номенклатура органических соединений — это свод правил, определяющих порядок составления их названий. Название органического соединения строго индивидуально, оно полностью отражает его строение.
|
Число одинаковых заместителей или функциональных групп обозначают греческими числительными (см. табл.), которые предшествуют их названию. Например, диметил-, гексаметил, диэтил- и т. д. При наличии двух заместителей в бензольном кольце наряду с цифрами используют также следующие приставки; положения 1,2- обозначают буквой о- (орто), 1,3- - м-(мета), 1,4- п- (пара). Положения 1; 2 и 1 - 8 нафталинового кольца обозначают также буквами: α (альфа) -1; β (бета) - 2 или приставкой пери-(в пер. с греч. - «около», «вокруг») -1,8.
Нумерация атомов С в молекулах нафталина и антрацена. |
НАЗВАНИЕ является визитной карточкой органического вещества. По названию химик легко должен представить себе структуру соединения и, наоборот, по структурной формуле составить название вещества.
| Происхождение названий алканов | |||
| Число атомов С | Формула алкана | Греческое числительное | Название алкана |
| 1 | СН4 | Моно | Метан |
| 2 | С2Нб | Ди | Этан |
| 3 | С3Н8 | Три | Пропан |
| 4 | С4Н10 | Тетра | Бутан |
| 5 | C5H12 | Пента | Пентан |
| 6 | C6H14 | Гекса | Гексан |
| 7 | C7H16 | Гепта | Гептан |
| 8 | С8Р18 | Окта | Октан |
| 9 | СgН20 | Нона | Нонан |
| 10 | С10Н22 | Дека | Декан |
| 11 | С11Н24 | Ундека | Ундекан |
| 20 | С20Н42 | Икоса | Икозан |
| 30 | C30H62 | Триаконта | Триаконтан |
| 40 | C42H86 | Тетраконта | Тетраконтан |
| 50 | C50H102 | Пентаконта | Пентаконтан |
| 100 | C100H202 | Гекато | Гектан |
Разработка системы образования названий органических веществ оказалась весьма нелегкой задачей. В настоящее время названия органических соединении составляют по правилам, соответствующим требованиям Международного союза по чистой и прикладной химии (IUPAC или ИЮПАК).
Углеводороды — родоначальники всех органических соединений. Заменяя необходимое число атомов Н в любом углеводороде на различные заместители, можно перейти к органическим соединениям различных классов. Углеводороды разделены на четыре основных класса: алканы — углеводороды, атомы С в которых соединены только одинарными связями, алкены — в углеродной цепи которых имеется хотя бы одна двойная связь, алкины, содержащие хотя бы одну тройную связь, и арены — ароматические углеводороды. Существуют и различные углеводороды смешанного типа.
|
Для замещенных карбоновых кислот положение заместителей у концевого и двух ближайших к карбоксильной группе атомов углерода обозначают также греческими буквами ω (омега), α и β соответственно:
ωCn - ... - βC3 - αC2 - C1OOH.
В этих
случаях буквенные обозначения используют в префиксе перед названием
заместителя, от которого буквы отделяют черточкой. |
Название первых четырех представителей ряда алканов с прямой цепью нужно просто запомнить — так же, как когда-то пришлось запоминать цифры или буквы азбуки. Названия остальных алканов с прямой цепью образуются путем прибавления суффикса -ан к корню соответствующего греческого числительного (см. табл.). Соответственно образуются и названия алкенов и алкинов. Если атомы углерода образуют цикл, то названия таких углеводородов содержат приставку цикло-. Углеводороды, содержащие двойную и тройную связи, имеют окончание -енин, а две двойные — -диен.
Арены разделяют на ряды, родоначальниками которых являются бензол, нафталин, антрацен и другие углеводороды без заместителей в кольцах. Указанная на рисунке нумерация положений заместителей у атомов С колец является обязательной. Если в цикле имеются заместители, то нумерацию начинают с атома углерода, несущего заместитель. Если заместителей несколько, нумерацию начинают с атома углерода, несущего самый старший заместитель.
Для соединений, молекулы которых состоят из циклических систем или аренов, содержащих нециклические заместители, название родоначального циклического или ароматического углеводорода составляет основу названия соединения.
| Названия часто встречающихся заместителей — радикалов | |||
| Радикал | Название | Радикал | Название |
| СН3 | Метил | -СН = СНСН3 | Пропенил*, пропен-1-ил |
| -СН2СН3 | Этил | -СН2СН = СН2 | Аллил*, пропен-2-ил |
______________________________
*
Тривиальные названия, существующие наряду
с систематическими.
Выбор главной цепи органической молекулы, нумерация атомов, использование специальных суффиксов и префиксов для обозначения классов органических веществ, радикалов и функциональных групп — основные этапы составления названий органических молекул.
|
Функциональной группой называется атом или группа
атомов, по которым органическое соединение относят к тому или иному
классу. Функциональные группы определяют основные свойства
органических соединений - реакционную способность, основность или
кислотность, растворимость и др. В префиксах заместители
располагаются в алфавитном порядке. |
ВЫБРАВ ГЛАВНУЮ ЦЕПЬ органической молекулы и установив старшинство заместителей, нужно к корню названия, соответствующего углеводороду, образующему главную цепь, добавить все необходимые префиксы и суффиксы в соответствии с правилами ИЮПАК. Выполнив эти действия, вы получите систематическое название органической молекулы. Помимо систематических названий применяют также и тривиальные названия. Однако в научных публикациях (статьях, монографиях и т. д.), как правило, используют систематические названия органических соединений. Исключение составляют тривиальные названия, которые стали общеизвестными, например: ацетон, бензол, нафталин, лимонная, уксусная, муравьиная и щавелевая кислоты, анилин, гидрохинон, названия аминокислот и многие другие.
ВЫБОР ГЛАВНОЙ ЦЕПИ — ключевой момент при составлении названия органического соединения. Это особенно важно для молекул, содержащих разные заместители. Они похожи на дерево: главная цепь — ствол, а заместители — ветки. От выбора главной цепи зависит правильное название соединения. Главная цепь должна быть как можно длиннее, содержать максимальное количество кратных связей и иметь максимальное количество заместителей и функциональных групп.
НУМЕРАЦИЯ АТОМОВ С, ОБРАЗУЮЩИХ ГЛАВНУЮ ЦЕПЬ. При составлении названия органического соединения нужно указать, к какому атому главной цепи присоединен тот или иной заместитель, где находится кратная связь, а где — функциональная группа. Для этого атомы С, входящие в главную цепь, нумеруют с того конца, к которому ближе расположена функциональная группа, кратная связь и заместители. Нумерацию атомов углерода в боковых цепях начинают с атома углерода, находящегося ближе к основной цепи или циклу. Если в молекуле имеется несколько одинаковых заместителей, то используют такие префиксы, как ди-, три-, тетра- и далее в соответствии с греческими числительными.
|
|
|
|
Формулы и названия углеводородов с несколькими кратными связями. |
Примеры нумерации основных и боковых цепей 2,5-диметил-3-этилгептан. |
Для того чтобы указать, в каком месте главной цепи органической молекулы расположена кратная связь, используют номера не обоих атомов углерода, соединенных кратной связью, а только одного — того, номер которого меньше. Таким образом, кратная связь соединяет указанный атом углерода с тем, номер которого больше на единицу.
НАЗВАНИЯ СОЕДИНЕНИЙ, ИМЕЮЩИХ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ. Основные функциональные группы и их место в названии — префикс или суффикс — приведены в таблице. Номер атома С, у которого находится заместитель или функциональная группа, отделяют от названия с помощью тире.
| Функциональная группа | Класс соединений | Общая формула | Префикс | Суффикс |
| -NO2 | Нитросоединения | R-NO2 | нитро- | - |
| -С*ООН | Карбоновые кислоты | R-CООH | - | -овая кислота |
| -СООН | Карбоновые кислоты | R-CООH | карбокси- | карбоновая кислота |
| -SО2ОH | Сульфокислоты | R-SO3H | сульфо- | -сульфокислота |
| -C*ОNH2 | Амиды кислот | R-CONH2 | - | -амид |
| -CHO | Альдегиды | R-CHO | формил- | -карбальдегид |
| -C*HO | Альдегиды | R-CHO | оксо- | -аль |
| -C* = O | Кетоны | R2CO | оксо- | -он |
| -OH | Спирты, фенолы | R-OH | гидрокси- | -ол |
| -SH | Меркаптаны | R-SH | меркапто- | -тиол |
| -NH2 | Амины | R-NH2 | амино- | -амин |
| -NHR | Амины | R2NH | алкиламино- | -амин |
Функциональные группы определяют принадлежность органических соединений к тому или иному классу, а также их реакционную способность и основные физические свойства — температуру кипения или плавления, растворимость в воде и органических растворителях. Ориентироваться в огромной массе органических веществ удается с помощью классификации — разделения их на основные классы. Каждый класс органических соединений характеризуется наличием определенной функциональной группы. Классификация органических веществ по такому признаку постоянно совершенствуется.
|
На различиях в химических свойствах функциональных групп органических соединений основано поведение их качественного и количественного анализов (функциональный анализ). Основной задачей функционального анализа является выбор таких химических реакций, которые были бы свойственны только определенным функциональным группам, и в результате проведения таких реакций образовывались бы продукты с характерными свойствами возникло бы изменение или появление окраски и агрегатного состояния, изменение растворимости, появление специфического запаха и т. п. |
Любую органическую молекулу можно расчленить на три основных составляющих — углеродный каркас, заместители и функциональные группы. Углеродный каркас, заместители и функциональные группы представляют собой некий конструктор, из которого можно собрать любую органическую молекулу. Более того, собрав молекулу, можно, заменяя один элемент на другой, перейти к химическому соединению любого класса. Таблица «Основные классы органических соединений (см. Справочные материалы) дает наглядное представление об основных классах органических соединений и возможных путях их синтеза.
Выбор способа получения определяется доступностью исходных веществ, условиями проведения реакций, устойчивостью получаемых промежуточных соединений и, наконец, простотой и надежностью методов выделения продуктов реакции.
Все органические соединения, относящиеся к одному классу, имеют в своей структуре одинаковую функциональную группу, вступают в одни и те же химические реакции и обладают довольно близкими химическими свойствами. Алкильные радикалы оказывают влияние на свойства функциональной группы, поэтому химические свойства разных представителей одного и того же класса органических соединений несколько различаются. Так, все спирты реагируют с натрием, но быстрее всех реагирует метанол. Если кусочек натрия кинуть в метанол, реакция будет бурной. Этанол реагирует немного медленнее — в этом случае водород будет выделяться довольно спокойно, пропанол — еще медленнее. А если натрий кинуть в 2,2-диметилпропанол — трет-бутанол — (Н3С)3СОН, то, для того чтобы реакция пошла, смесь придется кипятить.
| Различия в химических свойствах функциональных групп используют в качественном и количественном анализе органических соединений (функциональный анализ). Основной задачей функционального анализа является выбор таких химических реакций, которые были бы свойственны только определенным функциональным группам, а в результате проведения этих реакций образовывались бы продукты с характерными свойствами. |
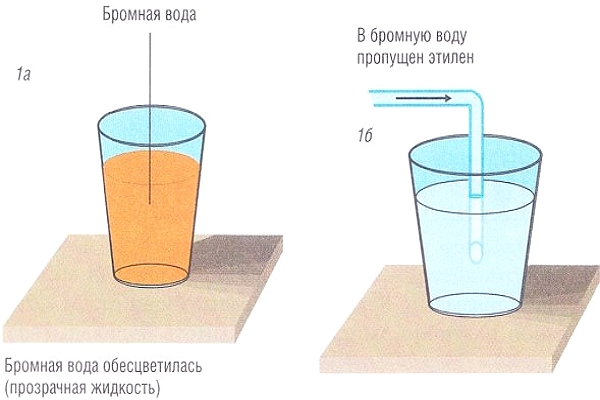 |
| Обесцвечивание бромной воды
является качественной реакцией на определение кратной связи
(например, этилена) (см. рис. 1а и 16). |
ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ зависят от природы функциональной группы. Например, простейшие представители класса алканов (метан, этан, пропан, бутан) — газы. Спирты (метанол, этанол, пропанол, бутанол) имеют намного более высокую температуру кипения и являются жидкостями. Замена атома водорода на группу — ОН также сильно влияет и на растворимость органического соединения в воде. Так, метан и этан не растворяются в воде, а соответствующие им спирты смешиваются с водой в любых соотношениях.
У ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, принадлежащих к одному
классу, физические свойства тоже зависят от природы алкильного радикала. Так, в
классе спиртов в ряду метанол — этанол — пропанол происходит повышение
температуры кипения; метанол кипит при 65, этанол — при 78, а пропанол — при 97°
С. То же самое наблюдается и в ряду аминов: метанамин является газом, его
температура кипения 7° С, этанамин — газ, кипящий уже при 17° С, а пропанамин —
летучая жидкость с температурой кипения 49 °С. Растворимость в воде спиртов
уменьшается с увеличением размера алкильного радикала. Метанол, этанол и
пропанол смешиваются с водой в любом соотношении. В 100 г воды растворяется 8 г
бутанола и всего 3 г пентанола.
Понятие о гибридных орбиталях объясняет характер связей в органических соединениях. Химическая связь в органической молекуле образуется за счет перекрывания гибридных орбиталей атомов углеродов s-орбиталями атомов водорода и других атомов.
| Понятие о гибридизации орбиталей атомов углерода и других элементов широко используется в органической химии. Оно необходимо в тех случаях, когда число неспаренных электронов в основном электронном состоянии атома или атомов оказывается меньше числа образуемых ими связей. При этом предполагается, что атомные орбитали с близкими значениями уровня энергии в результате взаимодействия образуют гибридные орбитали с одинаковой формой и энергией. |
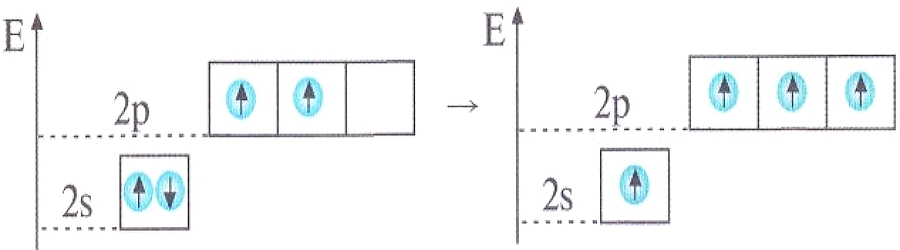 |
| Переход электрона в атоме С с подуровня 2s на подуровень 2р - объяснение четырехвалентности углерода. |
АТОМЫ в органических соединениях соединены ковалентной связью. Другие типы связей в органической химии встречаются редко. Ионная связь встречается в солях карбоновых кислот, а донорно-акцепторная — в солях аминов с кислотами.
Количество связей, которые может образовать атом, равно количеству имеющихся у него неспаренных электронов. Атом Н имеет только один неспаренный электрон, следовательно, он может образовать только одну связь.
В атомах элементов второго периода — углерода, азота, кислорода — электронов намного больше, но многие из них спарены.
Атом углерода имеет два неспаренных электрона, поэтому углеводород, содержащий один атом С, должен был бы иметь формулу СН2. Однако такого вещества не существует, а простейший углеводород — метан имеет формулу СН4. Полагают, что при сообщении атому С энергии один из электронов, находящихся на 2s-подуровне, переходит на 2р-подуровень, в результате чего и появляются четыре неспаренных электрона.
|
Виды гибридизации атома С |
|||
|
Состояние атома углерода |
Электронная конфигурация атома углерода |
Угол между гибридными орбиталями, град. |
Пример |
|
sp3-гибридизация |
1s2(2sp3)4 |
109,5 | CH3-CH2-R (алканы) |
| sp2-гибридизация | 1s2(2sp2)32p | 120 | CH2=CH-R (алкены) |
| sp-гибридизация | 1s2(2sp)22p2 | 180 | СН ≡ C-R (алкины) |
Атом С, имеющий 4 неспаренных электрона (три на р-подуровне и один на s-подуровне), должен был бы образовать молекулу СН4, в которой С — Н-связи неэквивалентны — три связи образованы электронами, находящимися на 2р-орбитали, а одна — электроном, находящимся на 2s-opбитали.
На рисунке показан вид атомных s- и р-орбиталей. На самом деле в молекуле метана все связи и все атомы водорода эквиваленты, и она имеет симметричное строение. Симметричное строение молекулы метана объясняют образованием четырех совершенно одинаковых так называемых гибридных орбиталей из одной s- и трех р-орбиталей. В молекуле метана гибридные орбитали располагаются на максимальном удалении друг от друга — по вершинам тетраэдра. Химическая связь в молекуле метана образуется за счет перекрывания гибридных орбиталей атома углерода с s-opбиталями атомов Н.
|
Перекрывание двух одноэлектронных атомных орбиталей является главным, но далеко не единственным способом образования ковалентных связей. Другой путь образования ковалентной связи заключается во взаимодействии свободной (вакантной) орбитали атома-акцептора со свободной парой электронов, находящихся на двухэлектронной орбитали атома-донора. Такая ковалентная связь называется донорно-акцепторной. Ее разновидностями являются семиполярная и водородная связи.
Молекула метана имеет тетраэдрическое строение. |
ОБЯЗАТЕЛЬНЫМ УСЛОВИЕМ образования гибридных орбиталей является наличие меньшего числа неспаренных электронов, чем число образуемых связей, а также близкие значения уровней энергии исходных атомных орбиталей, что имеет место в атоме углерода. В таблице приведены гибридные состояния атома углерода в органических соединениях. Напомним, что атом С в основном состоянии имеет электронную конфигурацию 1s22s22p2.
Образуя химическую связь, гибридные орбитали одних атомов перекрываются с орбиталями других атомов, при этом место перекрывания орбиталей оказывается на оси, связывающей атомы, — гибридные орбитали образуют только одинарные или σ-связи (сигма-связи) — осевое перекрывание.
Ковалентная связь характеризуется длиной, полярностью и поляризуемостью. Количественной мерой прочности ковалентной связи является энергия ее образования.
|
|
КОВАЛЕНТНАЯ СВЯЗЬ — основной тип связи в органических молекулах. Чем больше энергия, которую необходимо затратить для ее разрыва, тем прочнее связь. Связь слабо полярная, если разность электроотрицательности атомов менее 0,5; от 0,5 до 2,0 — сильно полярная, а при разности более 2,0 она приближается к ионной. Полярность связи количественно оценивают величиной ее дипольного момента.
| Характеристики основных ковалентных связей | ||||
| Связь | Гибридизация атома углерода | Длина связи, нм | Дипольный момент, Д | Энергия связи, кДж/моль |
| С-С | sp3 | 0,154 | 0 | 348 |
| C=C | sp2 | 0,134 | 0 | 620 |
| С≡С | sp | 0,120 | 0 | 814 |
| С-Н | sp3 | 0,110 | 0,40 | 414 |
| С-Н | sp2 | 0,107 | - | 435 |
| С-О | sp3 | 0,143 | 0,70 | 344 |
| С=О | sp2 | 0,121 | 2,40 | 708 |
| C-N | sp3 | 0,147 | 0,45 | 293 |
| С-СL | sp3 | 0,176 | 1,47 | 331 |
В таблице приведены характеристики ковалентных связей, часто встречающихся в органических молекулах. Электроны, образующие связь, могут смещаться вдоль нее под влиянием электрического поля. Подобное явление называют поляризуемостью связи. Поляризуемость связей уменьшается в следующей последовательности:
-С ≡ С - >> - С = С - >> - С - С -.
Различают два вида ковалентной связи — локализованную и делокализованную. Если электроны, образующие ковалентную связь, поделены между двумя ядрами атомов, ею связанных, связь является локализованной. Делокализованная ковалентная связь — это связь, молекулярная орбиталь которой охватывает более двух атомов.
Делокализация связи — очень частое явление в органической химии. Кратные связи (π-связи) практически всегда делокализованы. Делокализация характерна для системы связей, когда одинарные связи чередуются с двойными. Такие системы называются сопряженными. В π, π-сопряженных системах две двойные и одна одинарная связи лежат в одной плоскости, а все атомы С такой системы находятся в состоянии sp2-гибридизации. В р, π-сопряженных системах роль второй π-связи выполняет атом С с негибридизованной р-орбиталью — атомы углерода, имеющие свободную пару электронов (заряд « — »), неспаренный электрон (радикал) или несущие положительный заряд. Смещение электронной плотности при сопряжении показывают изогнутыми стрелками. Результатом сопряжения является выравнивание связей и зарядов. Образование сопряженной системы сопровождается увеличением степени перекрывания орбиталей и делокализацией р-электронов — т. е. приводит к энергетическому выигрышу, который составляет более 15 кДж/моль.
|
|
Ковалентная связь в органических соединениях «чутко отзывается» на воздействие электрического поля. Полярность, поляризуемость, делокализация и сопряжение — это непосредственное следствие влияния на связь в первую очередь ядер связанных ею атомов и атомов, расположенных в ближайшем окружении. Если связь полярная, то ближайшие 2 — 3 связи поляризуются, что приводит к возникновению частичных зарядов на соседних к связи атомах.
Такое влияние называют индуктивным эффектом (I). Его обозначают стрелкой, острие которой направлено к более электроотрицательному атому, а появление частичного заряда на атомах обозначают буквой (с верхним индексом, который показывает, уменьшилась « + » или « — » увеличилась электронная плотность (частичный заряд) на атоме в результате влияния на связь.
Пространственное строение органических молекул определяется размером атомов, характером химических связей, длинами связей и углами между ними.
| Изомерия положения, или
структурная изомерия, возникает в результате различий в расположении
углеродных атомов органической молекулы и является изомерией
углеродной цепи (углеродного скелета). Изомерия положения основана
на способности атомов углерода соединяться друг с другом с
образованием как прямых, так и разветвленных цепей. Количество возможных изомеров положения алканов определяется числом атомов углерода: алкан С5 имеет 3 изомера, Сб - 5, С7 - 9, С8 -18, С9 - 35, С10 - 75, С11 - 159, С12 — 355, С13 — 802, С14 — 1858, С15 - 4347, С20 - З66319, С30 - 36797588, а число изомеров углеводорода тетраконтана, содержащего 40 атомов углерода, выражается огромной цифрой 62491178805831. Совершенно очевидно, что далеко не все изомеры алканов встречаются в природе. Однако при необходимости возможно синтезировать нужный изомер, для чего зачастую приходится прибегать к специально разработанным методам синтеза, а также к довольно трудоемким способам разделения изомеров. |
ИЗОМЕРИЯ ПОЛОЖЕНИЯ. Молекулы большинства органических соединений построены из многих атомов. Обратимся к алканам и попробуем написать на бумаге все структурные формулы, которые вписываются в брутто-формулу каждого алкана. Простейшие алканы (метан, этан, пропан) можно изобразить только одной структурной формулой. Брутто-формуле C4H10 соответствует две структурные формулы (показан только углеродный остов):
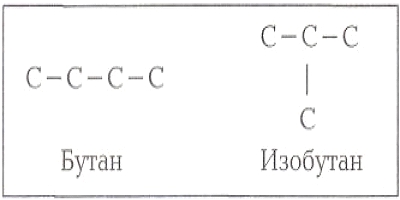
Молекулы, имеющие одинаковую брутто-формулу и отличающиеся строением или расположением атомов в пространстве, называются изомерами. Изомеры различаются по физическим и химическим свойствам.
Число изомеров алканов быстро увеличивается с ростом числа атомов С в молекуле. Такие изомеры называют изомерами положения. Изомерия положения далеко не единственный вид изомерии органических соединений.
При рассмотрении пространственного строения молекул необходимо все время помнить, что связи, образуемые атомами молекулы, имеют определенное направление в пространстве и характерную длину. Характеристика некоторых длин связей даны в таблице.
|
Длины отдельных связей в молекулах |
|||||
|
Связь |
Молекула |
Длина связи, 10-7 мм (Ǻ) |
Связь |
Молекула |
Длина связи, 10-7 мм (Ǻ) |
|
Н-Н |
Н2 |
0,741 |
С-Н |
Ацетилен |
1,055 |
|
Н-СL |
НСL |
1,274 |
С-Н |
Ароматическое кольцо |
1,084 |
|
N-H |
NH3 |
1,012 |
С-С |
Алмаз |
1,544 |
|
N-H |
RNН2 |
1,010 |
С-С |
Углеводороды |
1,537 |
|
N-H |
RCONH2 |
0,990-1,010 |
С=С |
Изолированная в углеводородах |
1,335 |
|
N-O |
RNО2 |
1,220 |
С=С |
Графит |
1,421 |
|
О-Н |
Н2О |
0,958 |
С=С |
Ароматическое кольцо |
1,394 |
|
O-Н |
RОН |
0,970 |
С≡С |
Изолированная в ацетилене |
1,202 |
|
О-О |
О2 |
1,207 |
C-N |
Амины |
1,472 |
|
О-О |
О3 |
1,278 |
C-N |
Пиридин |
1,339 |
|
О-О |
Н2О2 |
1,480 |
С-О |
Алифатические спирты, простые эфиры |
1,426 |
|
S-H |
H2S |
1,335 |
С-О |
Кислоты, сложные эфиры |
1,358 |
|
S-H |
RSH |
1,329 |
С-О |
Фенолы |
1,360 |
|
С-Н |
RСН3 |
1,096 |
С=О |
Альдегиды, кетоны |
1,215 |
|
С-Н |
Алкены |
1,083 |
С=О |
Кислоты, сложные эфиры |
1,233 |
Нужно учитывать, что каждый атом в молекуле также имеет свои размеры, а вокруг одинарных связей возможно вращение. Легкость вращения определяется величиной сил отталкивания заместителей у атомов, связанных связью, вокруг которой происходит вращение. Такое отталкивание носит название энергетического барьера вращения.
Таким образом, большинство органических молекул не могут быть плоскими. Известные исключения — ацетилен, бензол и др. — представляют собой случаи, когда реализуемые длины связей и углы между ними образуют плоскую структуру.
Пространственное строение молекул изучает специальный раздел химии — стереохимия.
Химические свойства органических соединений определяются химическими свойствами функциональных групп и основной цепи. Электронное строение связей, участвующих в реакции, определяет реакционную способность реагирующей молекулы.
| Галогеналканы находят широкое применение в химии и химической технологии. Многие галогеналканы являются распространенными не смешивающимися с водой (гидрофобными) растворителями - дихлорэтан C2H2CL2, хлороформ CHCL3 и др. Галогеналканы часто используют как исходные вещества в синтезе органических низко- и высокомолекулярных соединений полимеров. Так, хлористый этил C2H5CI применяется для получения тетраэтилсвинца (ТЭС) - широко известного и все еще используемого антидетонатора для двигателей внутреннего сгорания. Поливинилхлорид и инертный негорючий полимер тефлон получают из галогеналкенов - винилхлорида и тет-рафторэтилена. |
УГЛЕВОДОРОДЫ
Алканы. У алканов все связи неполярные, поэтому радикальные реакции протекают с большой легкостью:
хлорирование (атакующий радикал СL):
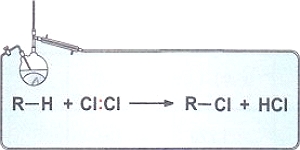
Нитрование (атакующий радикал NO2):
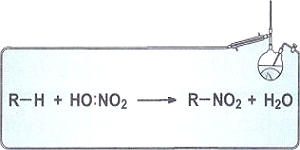
Такие реакции алканов называют реакциями радикального замещения. Галоидирование алканов представляет собой каскад последовательных актов; распад молекулы хлора с образованием радикалов — атомов хлора:
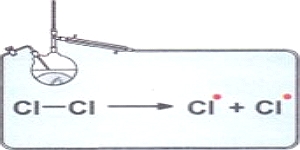
Атом хлора отрывает атом водорода от молекулы метана:
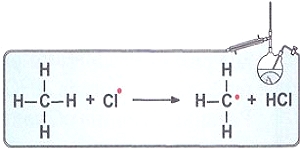
Метильный радикал отрывает атом хлора от молекулы хлора:
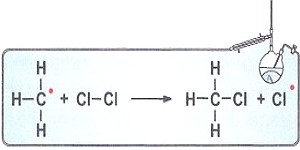
Галогеналканы. У галогеналканов из-за отрицательного I-эффекта атома галогена электронная плотность смещена и на атоме С возникает частичный положительный заряд.
|
Газообразные алканы являются основой природного газа. Жидкие и
твердые алканы содержатся в нефти. Алканы образуются при переработке
угля, торфа и древесины. Циклические алканы преимущественно с 6 - 10 атомами углерода входят в состав бензина, а жидкие алканы с большим числом атомов углерода являются основой дизельного топлива. |
|
|
|
Смещение электронной плотности в молекуле метилхлорида. |
ОСНОВНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ АЛКЕНОВ И АЛКИНОВ НА
ПРИМЕРЕ ЭТИЛЕНА И АЦЕТИЛЕНА
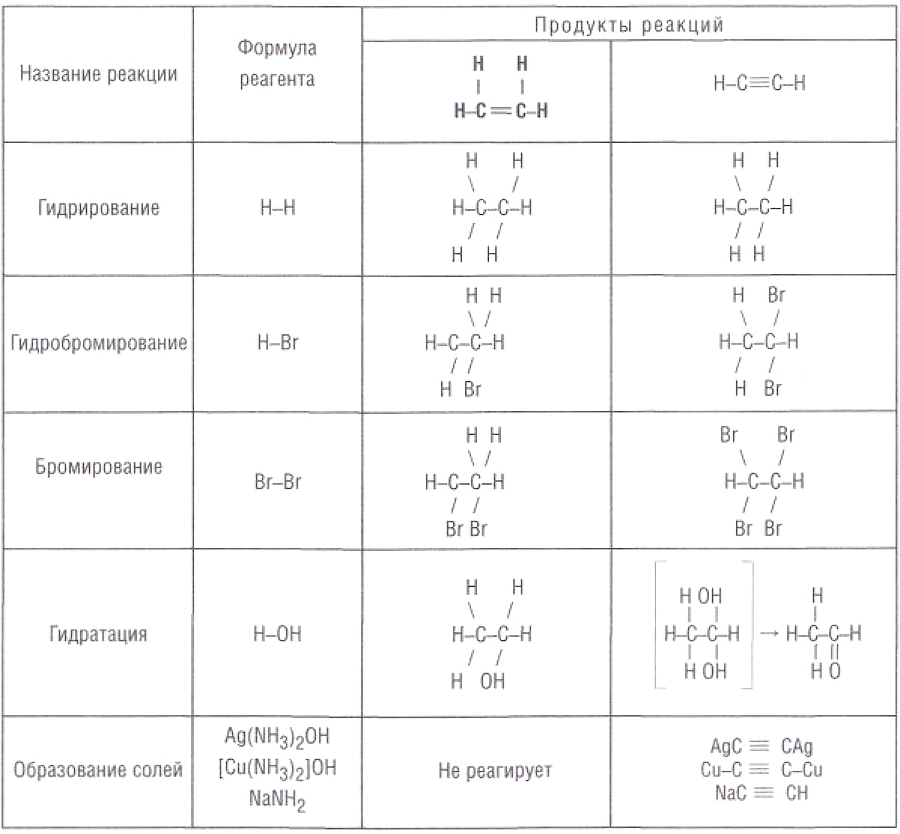
Полярность связи С — Hal способствует ионным реакциям, когда атом С атакует отрицательно заряженный реагент-нуклеофил (ОН-, NH2- и др.), вытесняющий анион галогена.
Реакции галогеналканов также являются реакциями замещения, однако в данном случае молекулу атакует не радикал, а анион — нуклеофил, поэтому эти реакции относят к реакциям нуклеофильного замещения.
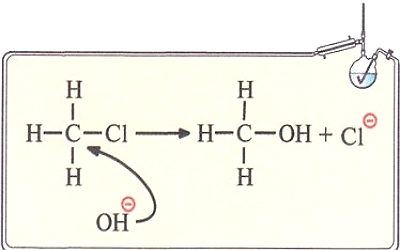 |
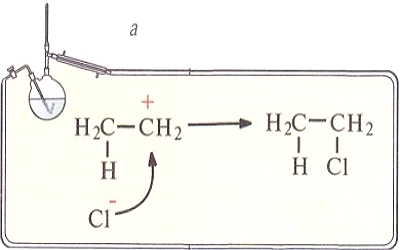 |
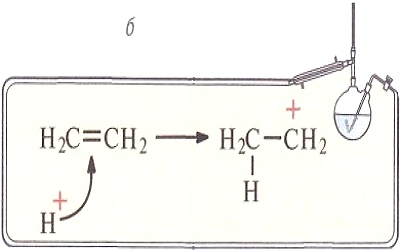 |
| Реакция
нуклеофильного замещения галогеналканов. |
Механизм электрофильного присоединения НСL к связи С=С. | |
Алкены. В молекулах алкенов имеются атомы С, связанные двойной связью С = С. На первый взгляд кажется, что порвать двойную связь труднее, чем одинарную. Однако алкены химически активнее алканов. Дело в том, что π-связь менее прочная, чем σ-связь, поэтому алкены легко вступают как в ионные, так и в радикальные реакции. Например, если к водному раствору брома прибавить какой-нибудь алкен, то через несколько секунд бромная вода обесцветится. Большинство реакций алкенов, заключающихся в разрыве π-связи, приводят к присоединению реагента к двойной связи.
π-связь в алкенах — место с повышенной электронной плотностью, в котором сконцентрирован отрицательный заряд, поэтому к нему стремятся подойти положительно заряженные частицы — электрофилы.
Электрофил разрывает π-связь (α) и присоединяется к одному из атомов углерода.
На второй стадии (6) к карбкатиону подходит нуклеофил — например ион СL- — и образует с ним связь.
Описанная последовательность превращений представляет собой механизм электрофильного присоединения молекулы НСL к связи С = С.
Тройная связь С ≡ С в алкинах состоит из одной σ- и двух π-связей. Наличие π-связей делает реакции присоединения характерными для алкенов. Алкен может присоединить только одну молекулу реагента, а алкин — две.
sp-гибридный атом С в алкинах более электроотрицательный, чем sp2- и sp3-атомы в алкенах и алканах. Связь С — Н в алкинах с концевой тройной связью оказывается более поляризованной, чем С — Н-связи в алканах и алкенах. В результате возникает небольшой положительный заряд на атоме Н. Благодаря этому алкины проявляют свойства очень слабых кислот — ацетилен может реагировать с аммиачными растворами оксидов меди (I) и серебра с образованием очень неустойчивых солей — ацетиленидов. Карбид кальция СаС2 также является ацетиленидом. При действии на СаС2 воды он гидролизуется с образованием ацетилена: СаС2 + 2Н2О = Н — С ≡ С — Н + Са(ОН)2. Эту реакцию используют иногда для получения ацетилена.
|
Многие арены обладают канцерогенным действием.
Попадая в организм и надолго задерживаясь в нем, полициклические
арены активизируют образование злокачественных новообразований.
Варианты написания формулы бензола. |
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ. Классическое ароматическое соединение — бензол — содержит три сопряженные двойные связи в шестичленном цикле. Соседние р-орбитали, образующие π-связь в бензоле, перекрываются друг с другом и связывают вместе все шесть атомов углерода.
В результате все связи между атомами углерода в бензоле оказываются эквивалентными.
Производные бензола — простейшие ароматические соединения. Остаток бензола С6Н5 называется фенильной группой или фенилом, π-связи в фенильной группе намного прочнее π-связей в алкенах, поэтому для ароматических соединений характерны реакции электрофильного замещения, в результате которых атом водорода в бензольном кольце замещается другим атомом или группой атомов. Например, бромирование:
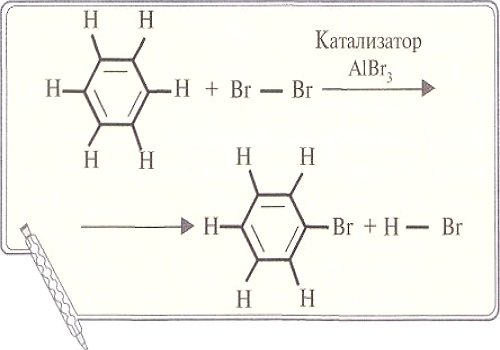
Нитрование:
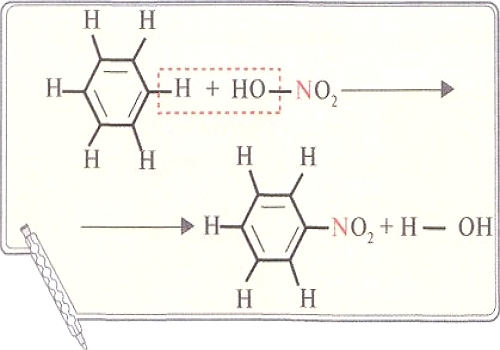
Сульфирование:
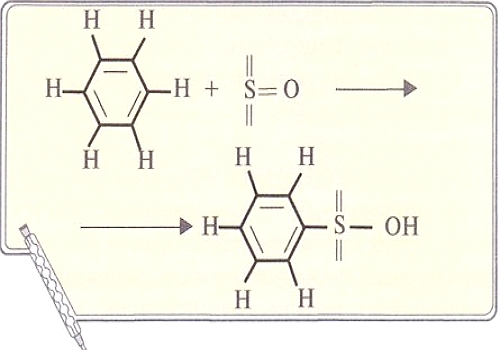
В молекуле бензола, так же как и у алкенов, имеется удобное для атаки электрофилом место — π-связь С — С, поэтому в результате атаки электрофила она разрывается, и образуется карбкатион.
Однако судьба образовавшегося карбкатиона отлична от судьбы такой частицы у алкенов — дело в том, что π-связи С = С в фенильной группе намного прочнее π-связей в алкенах, поэтому у ароматических соединений более выгодным оказывается отщепление иона Н+, приводящее к возникновению я-связи углерод — углерод.
| Бензол широко
используется как в качестве растворителя для нерастворимых в воде
веществ, так и в органическом синтезе. Из него получают нитробензол,
являющийся исходным продуктом в производстве анилина, красителей,
фармацевтических препаратов, хлорбензол и гекса-хлорциклогексан
(ДДТ), широко использовавшийся в качестве инсектицида, но
запрещенный к применению в настоящее время, циклогексан (для
производства циклогексанола, капролактама и полиамидов), стирол
(полистирол), малеиновый ангидрид (полиэфирные смолы) и множество
других ценных продуктов. Продукт полного нитрования толуола - тринитротолуол - является сырьем для получения взрывчатых веществ, применяемых как в военном деле, так и народном хозяйстве, в частности при проведении сейсмической разведки полезных ископаемых. Производные нафталина и антрацена используются в качестве промежуточных соединений в синтезе органических красителей. |
|
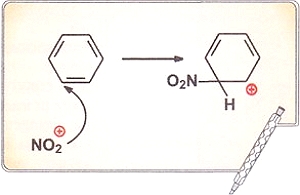 |
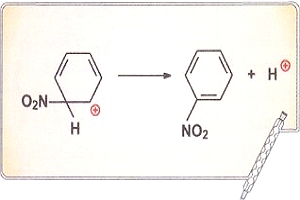 |
Из-за высокой прочности π-связей в фенильной группе бензол и другие ароматические углеводороды, молекулы которых получаются при соединении алкильного радикала с фенильной группой, намного менее химически активны, чем алкены. Это можно продемонстрировать на примере реакции с бромной водой — алкены мгновенно обесцвечивают бромную воду, а бензол не реагирует с ней. Бензол реагирует с бромом только в особых условиях в присутствии катализатора.
Среди ароматических соединений есть и очень активные вещества — например фенол и анилин, — они мгновенно реагируют с бромной водой. Анилин и фенол столь сильно отличаются по свойствам от бензола, потому что у них фенильная группа соединена непосредственно с функциональной группой — с NН2-группой у анилина и с ОН-группой у фенола. За счет положительного мезомерного эффекта NH2- и ОН-групп электронная плотность смещается на фенильную группу.
В результате реакции, сопровождающиеся атакой электрофила на фенильную группу, резко ускоряются. Отток электронной плотности с ОН-группы на фенильную группу увеличивает частичный положительный заряд на атоме водорода, благодаря этому взаимодействие атома водорода ОН-группы с гидроксидионом облегчается, и фенол оказывается более сильной кислотой, чем спирты.
Фенол реагирует со щелочами с образованием солей, а спирты нет.
| Наиболее известные
представители насыщенных альдегидов - формальдегид (40%-ный водный
раствор которого, называемый формалином, используется для хранения
анатомических образцов и как антисептическое средство) и
ацетальдегид (полупродукт для получения уксусной кислоты, ее
ангидрида и бутадиена), ненасыщенных - акролеин (полупродукт в
синтезе ацетона, глицерина и пиридина и др.). Важнейшим представителем насыщенных кетонов является ацетон, широко используемый в качестве растворителя, в производстве взрывчатых веществ, кино- и фотопленки и др. |
||
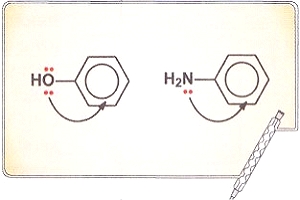 |
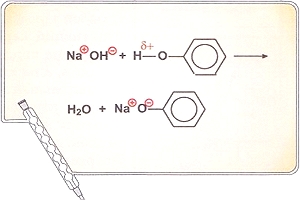 |
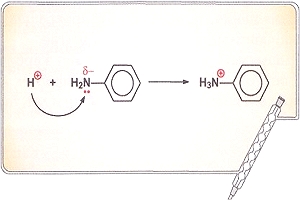 |
В случае анилина смещение электронной плотности с NH2-rpyппы к фенильной группе уменьшает частичный отрицательный заряд на атоме азота и затрудняет подход иона Н+ к атому азота.
Поэтому анилин оказывается более слабым основанием, чем аммиак и амины. По этой причине анилин не образует солей со слабыми кислотами в водных растворах — они быстро гидролизуются с образованием исходных веществ. Таким образом, взаимное влияние близкорасположенных функциональных групп приводит к усилению кислотных свойств ОН-группы в феноле, ослаблению основных свойств NН2-группы в анилине и колоссальному ускорению реакций замещения в фенильной группе.
Помимо бензола родоначальниками рядов ароматических углеводородов являются нафталин, антрацен и другие циклические углеводороды, состоящие из нескольких сочлененных бензольных колец. Кроме ароматических углеводородов к группе ароматических соединений относятся и различные циклические структуры, электронное строение которых отвечает условиям ароматичности.
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, так же как и алкены, содержат двойную связь, однако по химическим свойствам они сильно отличаются от алкенов: вещества, присоединяющиеся к алкенам (НСL, Н2О и др.), в большинстве случаев не реагируют с карбонильной группой, а реагенты, присоединяющиеся к карбонильной группе, не взаимодействуют с алкенами.
 |
 |
Одной из причин столь сильных различий между этими классами соединений является то, что двойная связь С = О в карбонильных соединениях намного полярное двойной связи С = С в алкенах. В карбонильной группе электронная плотность смещена от атома углерода к более электроотрицательному атому кислорода. В результате на углероде возникает частичный положительный заряд, и его охотно атакуют нуклеофилы. Атакующий карбонильную группу нуклеофил присоединяется к атому углерода, а на кислороде возникает отрицательный заряд.
Затем к отрицательно заряженному атому кислорода присоединяется электрофил, например ион Н+:
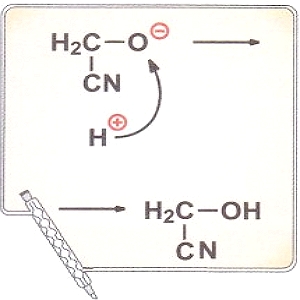
Эта реакция началась с атаки карбонильной группы молекулы нуклеофилом, поэтому ее называют нуклеофильным присоединением.
Для карбонильных соединений также характерны реакции замещения, приводящие к превращению одних классов карбонильных соединений в другие.
Например, при взаимодействии карбоновой кислоты со спиртом образуется сложный эфир — эта реакция этерификации (от греч. aither — эфир и лат. facere — делать):
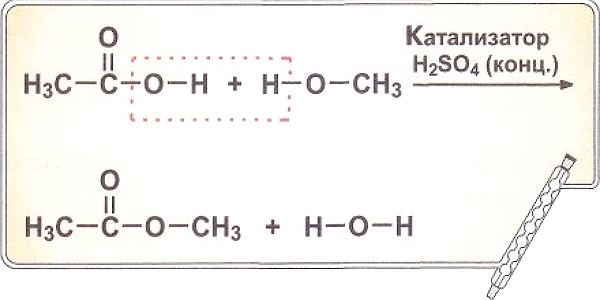
Наиболее известным классом карбонильных соединений являются карбоновые кислоты. Их можно получить окислением соединений, относящихся практически к любым другим классам органических соединений.
Из алканов:
алкенов:

спиртов:
альдегидов:
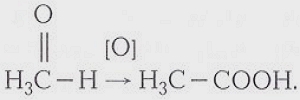
Связь О — Н в СООН-группе сильно поляризована — электронная плотность смещена в сторону атома кислорода, а на атоме водорода возникает частичный положительный заряд.
|
Введение электроотрицательных заместителей к атому углерода, присоединенному к карбоксильной группе, например галогенов, усиливает кислотность таких молекул: значения PK2 таких кислот ниже PK2 муравьиной кислоты - самой сильной из карбоновых кислот.
|
||||||||||||||
Благодаря этому атом водорода может легко отщепиться с образованием иона Н+.
Карбоновые кислоты сильнее угольной кислоты, они реагируют с металлами и щелочами и вытесняют угольную кислоту из ее солей:
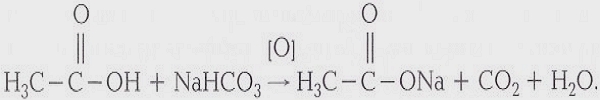
СПИРТЫ И АМИНЫ. Функциональные группы спиртов и аминов содержат полярную связь О — Н в спиртах и N — Н в аминах. Электронная плотность этих связей смещена от водорода к элементу, поэтому на атоме водорода возникает частичный положительный заряд, а на атоме элемента (кислорода и азота) — частичный отрицательный заряд.
Это благоприятствует реакциям, протекающим в водных растворах или протонных растворителях, в которых к атомам кислорода и азота подходят электрофильные агенты, например ион Н+ . При взаимодействии кислорода ОН-группы образуются очень неустойчивые соединения, которые легко распадаются по обратной реакции.
| Фурановое кольцо является основой структуры серии лекарственных препаратов, образующих семейство нитрофурановых антисептических и антимикробных средств. | |
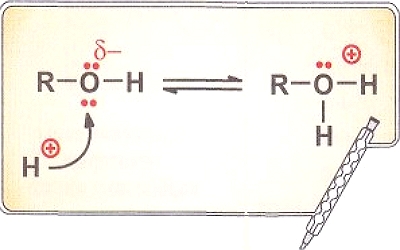 |
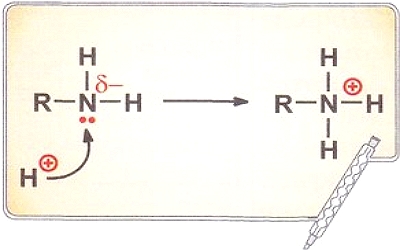 |
В случае аминов также возможна аналогичная реакция, в результате которой ион Н+ образует донорно-акцепторную связь с атомом азота. Однако у аминов, в отличие от спиртов, такие соединения оказываются вполне устойчивыми и представляют собой аналоги солей аммония. Наличие частичного положительного заряда на атоме водорода гидроксильной группы спиртов способствует отщеплению его в виде иона Н+, поэтому спирты и амины могут проявлять свойства кислот. Но по сравнению с кислотами полярность связи элемент — водород в спиртах и аминах ниже, чем в карбоновых кислотах, поэтому их кислотные свойства выражены гораздо слабее. Так, спирты не реагируют со щелочами, а образуют соли только при взаимодействии с сильными щелочными металлами: ROH + Na → RONa + Н2. Спирты являются слабыми кислотами, поэтому алкоголяты в присутствии воды гидролизуются с образованием исходного спирта. Кислотные свойства в ряду спиртов убывают от метанола к высшим спиртам.
Меньшая полярность связи N — Н по сравнению со связью О — Н и наличие неподеленной пары электронов у атома азота делают амины, в отличие от спиртов, основаниями. В результате индукционного эффекта основность аминов выше, чем у аммиака, и возрастает в следующем порядке:
NH3 < RNH2 < R2NH < R3N.
СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ. Органическое соединение, содержащее две одинаковые функциональные группы, называется бифункциональным, а две разные — гетерофункциональным. Среди гетерофункциональных соединений большое значение имеют аминокислоты — вещества, в молекулах которых содержатся NH2- и СООН-группы. Если NH2- и СООН-группы, принадлежащие двум разным аминокислотам, прореагируют между собой, то получится соединение, называемое дипептидом. Оно содержит одну NH2- и одну СООН-группу, а также пептидную связь и может дальше участвовать в аналогичной реакции.
Многократное повторение этих реакций приведет к получению полимера, называемого полипептидом или белком. Соединения, имеющие амидные связи и построенные не из аминокислот, чаще называют полиамидами. К ним относятся многие практически важные полимерные материалы — капрон, нейлон и др.
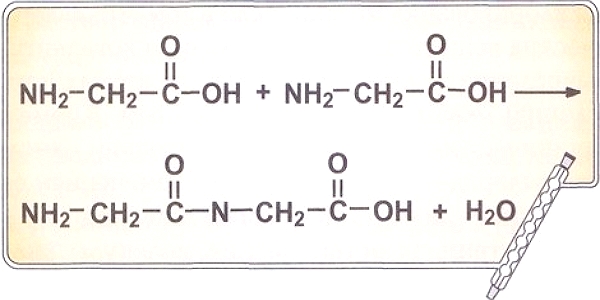
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Вещества, молекулы которых содержат циклы, состоящие только из атомов углерода, называют карбоциклическими; если цикл кроме атомов углерода содержит атомы других элементов, вещество называют гетероциклическим. Некоторые гетероциклические соединения напоминают по свойствам бензол и его производные.
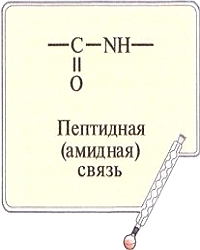 |
 |
 |
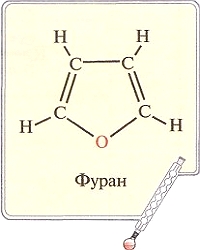 |
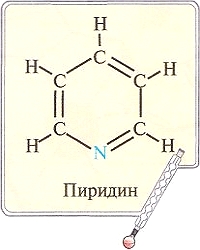 |
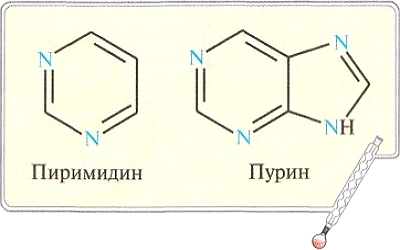 |
Например, пиридин, так же как и бензол, не реагирует с бромной водой. Пиррол, фуран и тиофен сильно отличаются от пиридина — они, как и фенол и анилин, быстро взаимодействуют с бромом, вступая в реакцию замещения.
Фрагменты некоторых гетероциклических соединений (пиримидин, пурин) входят в состав молекул, встречающихся в живой природе, например нуклеиновых кислот, содержащихся в клетках.
Производные пурина — аденин и гуанин — и пиримидина — тимин, урацил и цитозин — являются основаниями нуклеиновых кислот.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ. В органической химии имеется большое количество реакций, в которых элементы меняют степень окисления. Однако многие из таких реакций не считаются окислительно-восстановительными. Например, реакция хлорирования метана. Дело в том, что связи в органических веществах обычно являются ковалентными, и вычисление формального заряда на атомах (степени окисления) оказывается бессмысленным. Кроме того, в органической химии изменение степени окисления атома углерода не сопровождается изменением его валентности — она остается равной четырем.
|
|
|
Структура активного центра белка гемоглобина, переносчика кислорода в организме млекопитающих и человека. |
При действии на органические молекулы сильных окислителей (перманганата калия КМnО4, бихромата калия К2Сr2О7, оксида меди, аммиачного раствора оксида серебра, KIO4 и др.) образуются кислородные соединения. Такие реакции могут сопровождаться и разрывом углерод-углеродных связей (см. табл.). Реакции органических веществ с реагентами-окислителями называют реакциями окисления.
Алканы окисляются только в жестких условиях, остальные представленные в таблице классы соединений окисляются подкисленным раствором перманганата или бихромата калия. Алкены и спирты окисляются этими реагентами до карбонильных соединений — альдегидов и кетонов. Однако обычно альдегиды не удается выделить, так как они окисляются дальше до карбоновых кислот.
|
Вдыхаемый нами кислород принимает участие в качестве окислителя в окислительно-восстановительных реакциях организма, называемых аэробными процессами. В организме кислород переносится уникальным белком - гемоглобином. В анаэробных (без кислорода) окислительно-восстановительных процессах организма принимают участие металлы с переменной валентностью - Сu, Со и др. |
Существуют специальные реагенты (оксид меди (II) и др.), которые позволяют остановить реакцию окисления на первой стадии — на образовании альдегида. Имеются также реагенты — аммиачный раствор оксида серебра и щелочной раствор гидроксида меди (II), которые окисляют только альдегиды, а спирты не окисляют.
Реакциями восстановления называют реакции органических соединений с реагентами-восстановителями — водородом и др.
Так, реакции присоединения водорода к двойным связям в алкенах и карбонильных соединениях (С = С и С = О соответственно) относят к реакциям восстановления.
ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
|
|
Механизм химической реакции — это последовательность актов, приводящих к разрыву и образованию новой химической связи; он определяется особенностями химического строения реагентов и условиями проведения реакции.
| Понятие «механизм химической реакции» имеет два смысла. Если реакция простая и может быть разложена на отдельные химические акты, под этим понятием подразумевают физический процесс, лежащий в основе реакции. Это переход молекулы в возбужденное состояние, квантовое состояние молекулы, иона, радикала и т. д. Учитываются также и акты передачи энергии от частицы к частице. Для сложных химических реакций - это совокупность химических стадий, приводящих в итоге к превращению исходного вещества в конечный продукт реакции. В последнем случае стехиометрическое уравнение, как правило, не отражает механизма реакции. |
РЕАКЦИИ ОРГАНИЧЕСКИХ МОЛЕКУЛ в большинстве случаев достаточно сложны. Обычно их представляют как совокупность простых превращений реагирующих молекул (элементарные акты). Установление механизма реакции состоит в выяснении последовательности элементарных актов.
По типу разрыва ковалентной связи реакции подразделяют на гомолитические (в пер. с греч. — «равный» и «разложение», «распад») и гетеролитические (в пер. с греч. — «другой», «иной»). При гомолитическом разрыве связи С — С образуются два радикала, а при гетеролитическом — разноименно заряженные ионы.
Ниже приведены примеры реакций, протекающих по гомолитическому и гетеролитическому типам.
По числу реагирующих молекул реакции подразделяют на мономолекулярные, бимолекулярные. Реакций, в которых одновременно взаимодействуют 3 молекулы, очень мало, а более — практически нет.
| Условия проведения реакций | Примеры |
| Гомолитические | |
| Действие света, излучения, некоторых катализаторов, высокой температуры | Большинство цепных реакций - галоидирование насыщенных углеводородов, радикальная полимеризация и др. |
| Гетеролитические | |
| Присутствие сильных кислот или оснований, применение растворителей с высокой диэлектрической проницаемостью | Реакции замещения (нитрование и сульфирование ароматических соединений), отщепления, присоединения (присоединение воды, галогенов, галогеноводородов к С = С) и др. |
Так, термическая деструкция муравьиной кислоты HOOCH → СО2 + Н2 является мономолекулярной реакцией, а ее расщепление серной кислотой на СО и Н2О — бимолекулярная реакция.
|
Правило
Марковникова: при присоединении Н-НаI
и Н-ОН к С=С, атомы углерода которой имеют различное
число водородных атомов, атом водорода присоединяется к атому С,
соединенному с большим числом атомов водорода. Присоединение идет
против правила, если один из атомов С двойной связи имеет в
качестве заместителя -CF3, -СООН, CN. |
Гетеролитические реакции подразделяют на нуклеофильные (в пер. с греч. — «ядро» и «люблю») и электрофильные (в пер. с греч. — «электрон» и «люблю»). Нуклеофильными называют реакции, в которых молекулу атакует анион или агент с неподеленной (свободной) парой электронов. В электрофильных реакциях молекулу атакует частица с положительным зарядом. Ниже приведены механизмы гетеролитических реакций и их обозначения (к индексам Е и N обычно добавляют цифру 1 или 2, которые указывают порядок реакции).
Электрофильные реакции
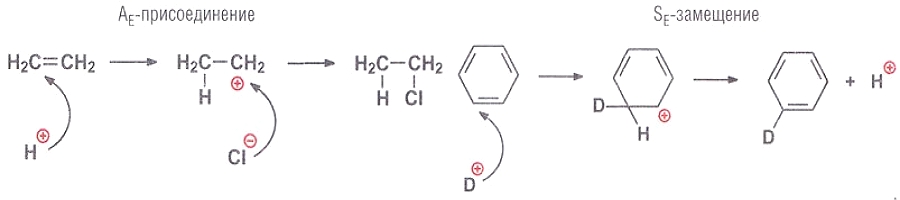
Нуклеофильные реакции
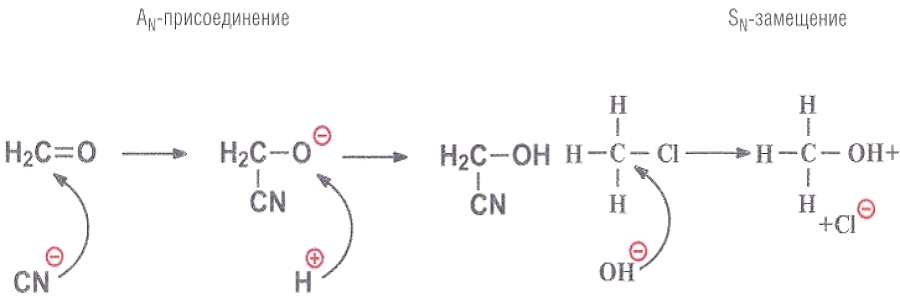
В мономолекулярных реакциях сначала образуется карбкатион или карбанион, который затем соединяется с противоположно заряженным атакующим ионом. Для бимолекулярных реакций характерно образование промежуточного комплекса, заряд которого определяется зарядом атакующей частицы или иона, с последующим отщеплением замещаемой группы. Атакующая группа, как правило, подходит со стороны, противоположной уходящему иону (атому или группе атомов). Если механизм химической реакции хорошо изучен, такая реакция становится управляемой. Подбором оптимальных условий для реализации механизма реакции удается повысить выход конечного продукта, сократить время проведения реакции и снизить энергетические затраты на ее осуществление.
Природные биологически активные вещества занимают особое место среди органических молекул. Это компоненты живых организмов, а также искусственные органические соединения, представляющие собой основу медицинских препаратов.
|
Из множества α-аминокислот некоторые встречаются лишь в определенных видах живых существ или даже только в одном организме. Потребности в аминокислотах различны для разных видов живых организмов. 8 аминокислот являются незаменимыми для человека и всех видов животных. Цыплята нуждаются в 15 таких аминокислотах. Некоторые микроорганизмы, например кишечная палочка, способны синтезировать все важнейшие аминокислоты, для других необходимо наличие в культуральной среде более десятка аминокислот. Отсутствие или недостаток в пище незаменимых аминокислот приводят к остановке роста, потере веса, нарушению обмена веществ, а в некоторых случаях и к заболеваниям. Например, отсутствие триптофана способствует развитию катаракты. D-аминокислоты встречаются очень редко - они находятся в клеточных стенках некоторых микроорганизмов и в ряде антибиотиков. D-Аланин является одним из предшественников кофермента А-активной части фермента - переносчика ацильных остатков. |
ВАЖНЕЙШИЕ АМИНОКИСЛОТЫ. Аминокислоты — это органические соединения, содержащие карбоксильные и аминогруппы. Наиболее важными являются аминокислоты. В природе их найдено около 300.
В составе белков встречается только 26 из них, при синтезе белка в него включается лишь 20 аминокислот, называемых протеиногенными, а остальные 6 образуются при модификации в составе белка. Растения и многие микроорганизмы могут синтезировать все необходимые им аминокислоты, а животные часть из них получают с пищей. Для этих аминокислот характерен ряд особенностей: амино- и карбоксильная группа в них присоединены к одному атому углерода, с которым связан также атом водорода и какой-либо радикал. Таким образом, этот атом является хиральным. Все аминокислоты, обнаруженные в белках, имеют L-конфигурацию у этого атома, т. е. являются L-L-аминокислотами.
По полярности R-групп аминокислоты делятся на четыре класса. Первый составляют аминокислоты с неполярными группами (Ala, Val, Leu, lie, Phe, Туг, Тгр). В белках эти аминокислоты формируют гидрофобное ядро.
Ко второму классу относятся аминокислоты с незаряженными полярными радикалами. Это оксиаминокислоты (Ser, Thr), амиды Asp и Glu, а также Cys и Met, содержащий серу. Эти радикалы при формировании третичной структуры белка способны образовывать водородные связи, а два остатка Cys, окисляясь в цистин, — дисульфидные мостики:
-CH2 - CH2 - SH + HS - CH2 - CH2- = -H2 - CH2 - S - S - CH2 - CH2-.
В третий класс входят кислые аминокислоты, радикал которых в нейтральной среде несет отрицательный заряд — Asp и GluАминокислоты четвертого класса в нейтральной среде заряжены положительно — это Lys, Arg и His. Аминокислотные остатки третьего и четвертого классов в белковой молекуле могут образовывать ионные связи.
|
Простейшая аминокислота - глицин, которая присутствует почти во всех белковых веществах. Глицин оптически не активен (не имеет хирального центра). Его свойства восстановителя используются в фотографии - он является основным компонентом глициновых проявителей в черно-белой фотографии.
|
Одна аминокислота — глицин — не относится ни к одному из классов, так как в качестве радикала содержит водород. Помимо перечисленных, в белках в небольшом количестве могут встречаться 4-оксипролин и 5-оксилизин, образующиеся при окислении пролина и лизина; фосфосерин, фосфотреонин и фосфотирозин — эфиры соответствующих оксиаминокислот и фосфорной кислоты и др. В нейтральных растворах происходит диссоциация протона от карбоксильной группы и протонирование аминогруппы, при этом образуется цвиттерион, а молекула в целом остается нейтральной.
Этим обусловлена значительная буферная емкость растворов аминокислот, а также их участие в поддержании постоянства величины pH в жидкостях живых клеток.
Другим важным свойством аминокислот является их способность образовывать соединения за счет конденсации карбоксильной группы одной аминокислоты и аминогруппы другой с образованием пептидной связи (см. выше).
Образующееся соединение, называемое дипептидом, так же как и исходные аминокислоты, содержит одну амино- и одну карбоксильную группы и может аналогичным образом реагировать со следующей аминокислотой, образуя трипептид, и т. д. Таким образом могут формироваться длинные полипептиды, состоящие из нескольких сотен аминокислот. Полипептидной цепи, состоящей из 100 аминокислотных остатков, может соответствовать 10130 молекул разных полипептидов. Если взять по одной молекуле каждого пептида, то, считая массу 1 аминокислоты в среднем равной 100, мы получили бы более 10104 т вещества (масса нашей галактики около 1040 т)!
БЕЛКИ определяют все важнейшие функции живых организмов. Полипептиды, синтезируемые живыми организмами, называются белками или протеинами. Характерной особенностью полипептидной цепи является чередование амидных CONH и метиновых СН групп:
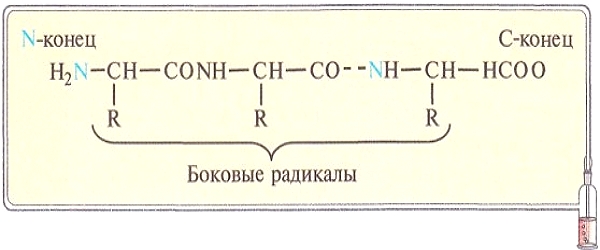
Аминокислотный состав белков устанавливают, идентифицируя аминокислоты, образующиеся в результате гидролиза (действием 20%-ной НСL при 110 С, либо ферментами) макромолекул. Если в состав белков входят кроме аминокислот другие соединения (углеводы, органические кислоты и т. д.), их называют протеидами. Внутри- и межмолекулярные слабые связи белков формируют их структуры.
|
Размеры молекул белка варьируются в широких пределах. Белковый гормон инсулин содержит 51 аминокислотный остаток и имеет молекулярную массу 5733 у. е., РНК-полимераза - около 450 000 у. е. Масса некоторых белков со сложной четвертичной структурой превосходит 1 млн у. е. Белки выполняют в живых организмах разнообразные функции. Важнейшая из них каталитическая. Большая часть белков живой клетки является биологическими катализаторами - ферментами. Второй важной функцией является структурная. Например, белок коллаген входит в состав соединительной ткани, хрящей, сухожилий. Кератин образует поверхностный слой кожи, волосы, перья, ногти и т. п. Белки осуществляют механико-химические превращения, обусловливая подвижность живых организмов; выполняют транспортную функцию, осуществляя перенос веществ как в клетке (специальные белки, переносящие вещества через мембрану клетки против градиента концентрации), так и в целом организме (например, гемоглобин переносит в крови кислород, трансферрин - ионы железа). Ряд белков выполняет функцию защиты. |
Выделяют четыре уровня организации полипептидов и белков: первичную, вторичную, третичную и четвертичную структуры. Первичной структурой называется последовательность аминокислот в полипептидной цепи. Она уникальна для каждого белка и определена генетически. Существуют автоматизированные приборы, осуществляющие последовательное отщепление аминокислот с одного конца полипептидной цепи. Наличие свободных амино- и карбоксильных групп в белках обусловливает их амфотерность. В зависимости от соотношения основных и кислотных групп для каждой первичной структуры существует определенная величина показателя pH, при которой молекула становится электронейтральной (изоэлектрическая точка — рI):
|
Величина рI белков определяется соотношением кислотных и основных групп в аминокислоте. |
Вторичная структура — регулярные образования, формирующиеся за счет водородных связей между С = О- и N — Н-группами полипептидной цепи. Наиболее распространены α-спираль и β-структура или складчатый слой, α-спираль является правозакрученной периодической структурой. Направление таких связей параллельно оси спирали, а радикалы аминокислот смотрят наружу. На один виток приходится 3,6 аминокислотных остатков, поэтому в одну сторону направлены радикалы аминокислот, расположенных через виток.
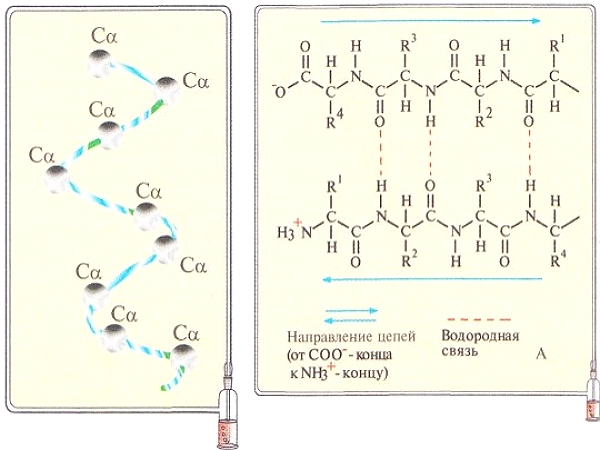
β-структура образуется участками полипептидной цепи, расположенными параллельно друг другу так, что против карбонила одной цепи находится амидная группа другой. Водородные связи лежат в той же плоскости, что и полипептидные цепи, а радикалы аминокислот направлены перпендикулярно этой плоскости. В большинстве белков присутствуют как α-спирали, так и β-структуры. 80% цепи гемоглобина свернуто в α-спираль, а β-структуры отсутствуют. В фиброине шелка большая часть полипептидной цепи образует β-складки.
|
Ферменты действуют в мягких условиях, т. е. при физиологических температурах, нормальном давлении в нейтральной среде. Например, нитрогеназа осуществляет синтез аммиака из азота и водорода в почвенных микроорганизмах. Химический синтез аммиака даже при использовании катализаторов протекает лишь при температуре в сотни градусов и давлении в сотни атмосфер. Крахмал устойчив к нагреванию в воде и гидролизуется лишь при кипячении с 1 н кислотой, а фермент амилаза гидролизует его при комнатной температуре.
β-складчатый слой. Полипептидные цепи удерживаются рядом друг с другом при помощи водородных связей, образующихся между NH- и СО-группами. R-группы аминокислот располагаются над и под плоскостью этого складчатого слоя (А). Две антипараллельныв полипептидные цепи (Б). Структура из трех полипептидных цепей изображена здесь так, чтобы показать складки между R-группами. |
Третичная структура белка формируется в основном за счет взаимодействия боковых радикалов, в этом могут участвовать ионные и водородные связи. Третичная структура нерегулярная и уникальна для каждого белка. Ее образование сопровождается вытеснением гидрофобных радикалов аминокислот из водной среды внутрь глобулы, где они формируют гидрофобное ядро. Третичная структура может фиксироваться дисульфидными связями между сближенными остатками цистеина. В результате формируется плотная структура со сложным расположением различных функциональных групп.
Четвертичная структура объединяет несколько полипептидных цепей в единую структуру. Полипептиды, образующие белок с четвертичной структурой, называются субъединицами белка. Четвертичная структура может образовываться одинаковыми или разными субъединицами, число субъединиц так же может быть различно. Некоторые белки, например ферменты, участвующие в матричном синтезе и преобразовании энергии, состоят из большого числа различных субъединиц.
|
Многим ферментам для работы требуются те или иные
небелковые компоненты, которые не изменяются в результате реакции
или регенерируются после ее завершения. Они называются кофакторами.
В качестве кофакторов могут функционировать неорганические ионы,
нуклеотиды, производные витаминов. Если органический кофактор прочно
связан с ферментом, его называют простетической группой, а если
диссоциирует - коферментом.
Третичная структура рибонуклеазы. В образовании активного центра участвуют аминокислотные остатки 12 и 119 (остатки гистидина), а также 7 и 41 (остатки лизина). Рибонуклеаза катализирует гидролитическое расщепление рибонуклеиновых кислот до нуклеотидов. |
По своей структуре белки делят на фибриллярные и глобулярные. В фибриллярных белках полипептидная цепь имеет вытянутую конформацию, стабилизированную большим числом водородных связей. Подавляющее большинство белков имеет глобулярную структуру, которая характеризуется компактным сворачиванием полипептидной цепи в структуру, близкую к сферической.
|
Четвертичная структура белка. |
ФЕРМЕНТЫ — это белковые катализаторы химических реакций, протекающих в живых организмах. Всего известно 3000 ферментов, их молекулярная масса обычно находится в пределах от 1,5 х 104 до 106 у. е. Одна молекула фермента превращает 102 — 106 молекул субстрата! Субстратом называют молекулу, химическое превращение которой катализирует фермент. Ферменты, как и остальные катализаторы, увеличивают скорости химических реакций и значительно снижают энергетические затраты на их проведение, так как реакции с их участием протекают при низкой температуре (температуре тела или растения).
Ферменты отличаются высокой субстратной специфичностью, поэтому в ферментативных реакциях побочные процессы незначительны. Одни ферменты катализируют превращение только одного субстрата, другие — расщепляют или образовывают определенные типы химических связей. Создана номенклатура и классификация ферментов. Ниже приведены 6 главных классов ферментов:
| Класс | Катализируемые реакции |
| Оксидоредуктазы | Окислительно-восстановительные |
| Трансферазы | Реакция типа: X - Y + Z = X + Y - Z |
| Гидролазы | Гидролитическое расщепление связей |
| Лиазы | Реакции отщепления с образованием двойных связей и обратные им |
| Изомеразы | Изменение геометрической или пространственной конфигурации молекул |
| Лигазы | Соединение двух молекул, сопровождающееся разрывом богатой энергией связи |
Каждый из классов, в свою очередь, делится на подклассы и подподклассы. Специфичность действия ферментов наглядно объясняет гипотеза «ключа — замка».
|
Фишеровская гипотеза «ключа - замка» о связывании субстрата с ферментом. |
Механизмы действия фермента Е сложны. Только небольшое число аминокислотных остатков участвует в катализируемой реакции (активный центр). Остальная часть молекулы фермента удерживает субстрат S в нужном положении, образуя фермент-субстратный комплекс EIS. Химические превращения субстрата осуществляются в EIS, при этом S «растягивается» в активном центре, как на дыбе, что снижает затраты энергии на проведение реакции. При действии фермента меняется конформация как белковой молекулы, так и субстрата. Когда субстрат превратится в продукт реакции Р, фермент принимает исходное состояние:
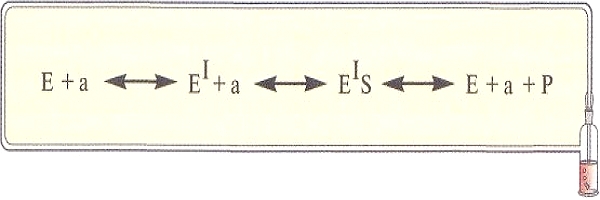
В состав активного центра может входить и небелковая молекула — кофермент. Для перевода некоторых ферментов в активное состояние необходимо воздействие другой молекулы или иона. Взаимодействие иных молекул с ферментами может деформировать активный центр последних, что приводит к замедлению или остановке катализируемой реакции. Молекулы, влияющие на фермент, называются эффекторами-активаторами (А), или ингибиторами. Такие взаимодействия лежат в основе механизмов регуляции каталитической активности ферментов в живых организмах.
|
Электронная микрофотография - Т-лимфоцит. |
При изменении величины показателя pH, повышении температуры до 40 - 60° С, облучении ультрафиолетовым светом и других воздействиях слабые связи, определяющие пространственную структуру белковой молекулы, рвутся, ее структура изменяется и фермент теряет катализирующую активность. Разрушение природной макроструктуры белков называется денатурацией. Денатурированный белок теряет свои биологические свойства.
|
Классы и подклассы иммуноглобулинов у человека. |
ИММУНОГЛОБУЛИНЫ — это глобулярные белки, способные связывать в организме антигены — чужеродные органические молекулы. У человека известно пять классов иммуноглобулинов — IgA, IgD, IgE, IgG и IgM. Каждый класс иммуноглобулинов делится на подклассы. В организме эти белки (антитела) находятся в крови и других жидкостях, а синтезируются В- и Т-лимфоцитами. После связывания с антигеном (бактериями, вирусами и др.) антитела активизируют специфические функции организма, обеспечивая тем самым его защиту от воздействия антигенов. Основным иммуноглобулином является IgG, он составляет большую часть антител крови. Присоединение молекул антигена к IgE сопровождается выбросом гистамина и серотонина, вызывающих аллергические реакции. IgA присутствует в слюне, молозиве, слезах, кишечном соке, выполняя защитные функции. Все иммуноглобулины имеют постоянные (С) и вариабельные (изменяемые V) участки полипептидных цепей, что обеспечивает их видовую стабильность и разнообразную антигенную специфичность.
УГЛЕВОДЫ — это полигидроксикарбонильные производные углеводородов. Общая формула углеводов — (СН2О)х, где х 3. Карбонильная группа в углеводах находится либо на конце (альдегидо-спирты или альдозы), либо внутри молекулы (кето-спирты или кетозы). Большинство простейших углеводов — моносахаридов — относятся к альдегидо-спиртам. Молекулы моносахаридов могут содержать от 3 до 9 атомов С — триозы, тетрозы, пентозы, гексозы и т. д. Ниже даны структурные формулы различных моносахаридов D-ряда.

Моносахариды, углеродная цепь которых состоит более чем из 6 атомов С, называются высшими сахарами. Для моносахаридов характерно нахождение в двух формах — циклической (в твердом состоянии — исключительно, в растворе — преимущественно) и линейной, которые находятся в равновесии.
|
Полипептидные цепи иммуноглобулинов подразделяют на тяжелые (Н) и легкие (L). На примере строения IgG можно наблюдать характерные особенности строения иммуноглобулинов. IgG содержит две Н- и две L-цепи. Н- и L-цепи объединяются в четырехцепочную молекулу IgG с помощью ковалентных дисульфидных связей. V-участки Н- и L-цепей иммуноглобулинов формируют активный центр (антигенсвязывающую область) антител всех классов иммуноглобулинов. Принадлежность иммуноглобулина к тому или иному классу и подклассу определяется особенностями строения его Н-цепей - количеством и последовательностью аминокислотных остатков, величиной молекулярной массы, числом доменов и дисульфидных связей и составом углеводов. Молекула IgM имеет наиболее сложную организацию. Она состоит из 5 мономеров, каждый из которых имеет две L-цепи. Мономеры объединяются в единую молекулу с помощью дисульфидных связей. IgM способна проявлять валентность 10 при связывании низкомолекулярных молекул, а при связывании сложных по химическому строению и больших антигенов из-за стереохимических ограничений валентность IgM не более 5. |
Важно знать принятую нумерацию атомов углерода в пиранозном и пентозном кольцах циклических форм, а также обозначение пространственного положения ОН-группы при С1 пиранозного кольца (α- или β-).
Число хиральных атомов С можно определить следующими выражениями: х-2 (альдозы) и х-3 (кетозы), где х — число атомов углерода в молекуле моносахарида. Образование циклической формы приводит к появлению нового хирального центра — атом C1. При этом возможно образование изомерных циклических форм (α- и β-аномеров). В результате равновесия:
α-аномер ← линейная форма → β-аномер
в растворах моносахаридов присутствуют все три моносахаридные структуры. Принято, что хиральный С1 атом имеет следующие конфигурации, определяющие его принадлежность к D- или L-ряду (см. табл.).
Химические свойства моносахаридов определяются наличием ОН- и >С = О-групп. При действии восстановителей (водород с катализатором, комплексные гидриды металлов, например NaBH4, и др.) моносахариды превращаются в полиспирты:
НОСН2 - (НСОН)4 - СН = О → Н0СН2 - (НС0Н)4 - СН2ОН.
Альдозы легко окисляются с образованием различных продуктов:
НОСН2 - (НСОН)х - СН = О → НОСН2 - (НСОН)х - СООН (альдоновая кислота),
а если окислитель сильный (КМnО4, СгОз и т. д.), происходит глубокое окисление моносахарида вплоть до СО2 и Н2О. Альдозы — сильные восстановители, для их качественного определения используют реакцию серебряного зеркала: Аg+ + е- → Аg0↓.
| Дисахариды: 1. Сахароза - соединение глюкозы и фруктозы. Она является одним из главных веществ, «запасающих» впрок углеводы в растениях. 2. Лактоза - соединение глюкозы и галактозы. Образуется в млечных железах млекопитающих и служит основным источником энергии для их детенышей. 3. Мальтоза образована двумя остатками глюкозы. В живых организмах образуется в больших количествах при расщеплении крахмала и гликогена. |
||
 |
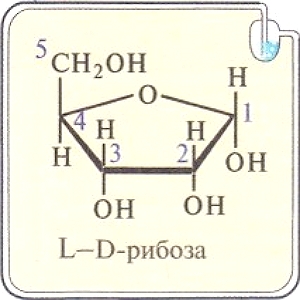 |
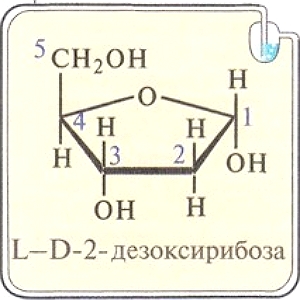 |
| Структурные формулы моносахаридов. | ||
Очень важной реакцией углеводов является окислительное расщепление α-гликольной групппировки йодной кислотой (периодатное окисление) с разрывом С — С-связи и образованием двух молекул альдегида:
R - СНОН - СНОН - R1 + HIО4 - RCHО + R1CHO + H2O + HIO3.
Периодатное окисление широко используется в химии углеводов при установлении их строения.
Образование циклических форм моносахаридов происходит в результате присоединения ОН-группы молекулы моносахарида к его >С = 0-группе. Появляющаяся при этом у C1-атома ОН-группа (ее называют полуацетальной) отличается повышенной реакционной способностью, так как благодаря I-эффекту О-атома цикла электронная плотность на C1-атоме повышена. Поэтому НО — C1 легко вступает в реакции нуклеофильного замещения. При этом образуются R — C1 — X, где X — галоген, остаток кислоты (R1COO —) и т. д. Наиболее важны гликозиды — обширный класс соединений, в которых X — алкокси-, арилокси-, амино- и некоторые другие группы (нуклеозиды, коферменты, переносчики энергии, лекарственные препараты, см. ниже).
 |
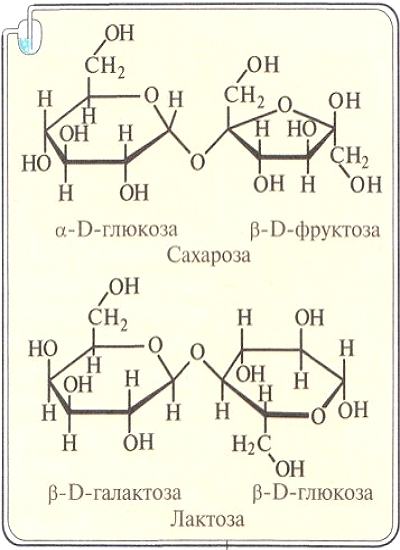 |
Моносахариды образуются в растениях в результате фотосинтеза. При взаимодействии между ОН — С1 одного моносахарида и иными кислородными группами другого моносахарида с отщеплением воды образуется гликозидная связь, соединяющая две углеводные молекулы в димер, дисахарид. Построенные таким образом полимеры называются полисахаридами.
Например, сахароза представляет собой дисахарид, в котором β-D-глюкоза и β-D-фруктоза соединены α-1,2-β-гликозидной связью.
Биологическая роль углеводов велика. Например, их используют в качестве исходного сырья для биосинтеза различных классов соединений, расщепление углеводов обеспечивает энергией живые существа и т. д. Полисахариды являются основным строительным материалом клеточных стенок и таких сложных живых систем, как растения.
|
Названия нуклеозидов и нуклеотидов происходят от тривиальных названий оснований; аденин - аденозин - адениловая кислота, гуанин - гуанозин - гуаниловая кислота, тимин - тимидин - тимидиновая кислота, цитозин - цитидин - цитидиновая кислота, урацил - уридин - уридиновая кислота. Нуклеотиды - это нуклеозиды, у которых гидроксильная группа у С5- или С3- атома пентозного углеводного цикла содержит остаток фосфорной кислоты - нуклеозид-5´, или 3´-фосфаты: цитидин-3’-фосфат, аденозин-5’-фосфат. Если фосфатная группа присоединена к ОН-группе, у С5-атома углевода буква «р» ставится слева - рА, и буква «р» ставится справа, если фосфатная группа у С3-атома углевода - Ар. Для обозначения дезоксинуклеотидов используют приставку дезокси- или букву «d». |
НУКЛЕИНОВЫЕ КИСЛОТЫ — биополимеры, играющие главную роль в хранении и передаче наследственных признаков и управлении процессом биосинтеза белка. Молекулы нуклеиновых кислот (НК) построены из нуклеотидов, которые являются мономерными звеньями этих биополимеров. В свою очередь, нуклеотид состоит из нуклеозида — остатка гетероциклического основания — производного пурина или пиримидина, соединенного с D-рибозой или 2-дезокси-D-рибозой β-гликозидной связью, при этом пентозное кольцо моносахарида имеет остаток фосфорной кислоты — фосфат, присоединенный сложноэфирной связью. Схема строения нуклеотида следующая:
[гетероциклическое основание] — [D-рибоза или 2-дезокси-D-рибоза] — [фосфорная кислота].
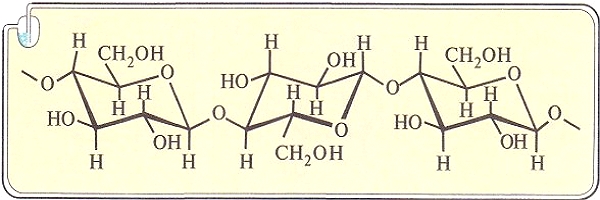
β-Н-гликозидная связь в нуклеотидах стабильна в щелочной среде. Гликозидные связи с пуриновыми основаниями легко гидролизуются в кислой среде, а для разрыва ее с пиримидинами требуется применять концентрированные кислоты.
Нуклеотиды имеют свободные кислотные группы — R — О — РО — (ОН)2 и являются довольно сильными кислотами. Нуклеотиды образуют полимерные цепи ДНК и РНК, соединяясь друг с другом фосфодиэфирными связями: гидроксильные группы при С3- и С5-атомах двух остатков ри-бозы образуют сложноэфирные связи с фосфорной кислотой.
|
Схема двойной спирали ДНК. |
По строению НК разделяют на два класса: дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). ДНК ответственны за хранение генетической информации, РНК — за обеспечение синтеза белка. В отличие от белков, молекулы которых построены из 20 аминокислот, длинные полимерные цепи НК создаются всего из 4 нуклеотидов. Чередующиеся остатки пентозы и фосфата в структуре НК образуют линейный углеводно-фосфатный остов, от которого отходят азотистые основания. На одном конце молекулы НК находится остаток углевода со свободной ОН-группой у С3-атома, а на другом конце — у С5.
|
Модель ДНК (В-форма). |
ДНК представляет собой двойную спираль из двух полинуклеотидных цепей, закрученную вправо. Две цепи ДНК комплементарны — в них обязательно соединяются водородными связями аденин с тимином, а гуанин с цитозином:
----AGTCAT----
----TCAGTA----
Из рисунков видно, что гетероциклические основания находятся внутри спирали. Цепи в двойной спирали ДНК антипараллельны: так, если в одной цепи фосфодиэфирные связи между нуклеозидами направлены
51 → 31, то в другой цепи 31 → 51.
Существуют три формы двухспиральных ДНК — А, В и С. В-форма имеет диаметр 2 нм, шаг 3,4 нм с расстояниями между плоскостями оснований 0,34 нм. Каждый виток спирали в В-форме состоит из 10 пар оснований. А-форма образуется, когда влажность образца ДНК становится <75%, в этом состоянии пары оснований не перпендикулярны оси спирали (наклон ~20°), и шаг спирали составляет 2,8 нм. А-форма имеет 11 пар оснований на виток и короче В-формы на —25%. С-форма похожа на В-форму — шаг спирали равен 3,3 нм, а виток состоит из 9 пар оснований.
|
Углеводно-фосфатный остов. |
Размеры ДНК определяются видом организма: ДНК вирусов содержит ~5 х 103, дрожжей ~1000 х 103 а человека — 125 000 х 103 пар оснований.
В отличие от ДНК, РНК имеет одну цепь. Существует три вида РНК: матричная (мРНК, короткоживущая молекула, ее размеры определяются величиной белка, который должен быть синтезирован) — содержит информацию о последовательности аминокислот в белках организма, транспортная (тРНК, до 20% клеточной РНК, ~30000 у. е.) — обеспечивает доставку активированных аминокислот к месту синтеза белков, причем каждой аминокислоте соответствует специальная тРНК, рибосомная (рРНК, большая часть РНК клетки, где она присутствует в виде трех компонентов с различной плотностью) — играет основную роль в формировании рибосом, где происходит синтез белков.
К середине 70-х годов XX в. были выяснены механизмы воспроизводства генетической информации, закодированной в нуклеиновых кислотах, прежде всего в ДНК, а в конце XX в. были расшифрованы геномы человека и некоторых животных.
|
Расшифровка генов, а затем и всего генетического кода живых
организмов -огромная и очень тонкая работа. В последний год XX в.
был расшифрован и геном человека. |
ОСНОВНОЕ СВОЙСТВО всех живых организмов — способность к воспроизведению себе подобных. При этом основные признаки, присущие предкам и родителям, наследуются потомством. Молекулярный механизм наследственности был расшифрован только в середине XX в., после того как было выяснено, что молекулами наследственности являются ДНК. Поскольку ДНК всех живых организмов построены из миллионов мономерных звеньев, состоящих всего из четырех типов мономеров (см. НК и нуклеотиды), информация, содержащаяся в ДНК, кодируется порядком чередования четырех нуклеотидов. Последовательность нуклеотидов, кодирующих структуру того или иного белка, называется геном. Гены располагаются линейно в цепи ДНК и разделены фрагментами, которые сами не участвуют в коде, а помогают регулировать работу генов. По аналогии с текстом такие фрагменты можно назвать знаками препинания.
На рисунке показано, как с помощью водородных связей между гетероциклическими основаниями соединены две комплементарные цепи ДНК. Попарное связывание пуринового и пиримидинового оснований в цепи обеспечивает одинаковые размеры пар А — Т и G — С (1,085 нм) и стройность двухспиральной конструкции ДНК. Принцип комплементарности объясняет механизм точного удвоения генетической информации в процессе размножения организмов, состоящих как из одной, так и из множества клеток. Удвоение ДНК называется репликацией. В процессе репликации две нити ДНК расплетаются, и на каждой из них специальный фермент (ДНК-полимераза) строит вторую цепь в точном соответствии с принципом комплементарности. У некоторых организмов, в частности у бактерий, двухспиральная ДНК замкнута в кольцевые структуры, у высших животных и человека двухспиральная ДНК линейна. Особенность процесса удвоения ДНК в процессе размножения клеток заключается в том, что репликация всегда начинается в строго определенной области и заканчивается в другой, также жестко определенной области. Такие области содержат специфическую последовательность нуклеотидов, узнаваемую соответствующими ферментами, которые получат команду начать или закончить сборку новой полинуклеотидной цепи.
|
|
|
|
Электронная микрофотография, показывающая образование петли ДНК (интрон - участок ДНК, отсутствующий в мРНК) в результате слияния двух генов, а также схему этого процесса и последующей транскрипции мРНК. |
|
Важно, что ферменты репликативного комплекса безразличны к последовательностям нуклеотидов, расположенных между точками начала и конца репликации. Даже в случаях, когда между этими точками находится новый или совершенно чужой ген, репликативная машина не заметит этого и будет удваивать чужой ген, как свой собственный. В этом и состоит одна из причин мутаций — появления новых признаков у организма. Химическая основа мутации — локальное повреждение фрагмента ДНК под действием тех или иных факторов.
Основой жизнедеятельности организма являются белки — они участвуют в построении оболочек клеток и клеточных органелл — отдельных структур клетки. Ферменты, природные биокатализаторы, также являются белками. Организмы содержат тысячи различных белков. В молекулах ДНК записана подробнейшая информация об аминокислотной последовательности каждого белка организма, а следовательно, о их пространственных структурах и специфических биологических функциях. Вся информация, содержащаяся в ДНК, составляет генетический код.
Каждой аминокислоте, входящей в первичную структуру белка, соответствует одна или несколько последовательностей из трех нуклеотидов. Таким образом, генетический код — триплетный. Последовательность из трех нуклеотидов, соответствующая аминокислоте, называется кодоном. Из 4 нуклеотидов можно сделать всего 64 кодона. 61 кодон отвечает за аминокислотную последовательность белка, а 3 кодона — это знаки препинания, означающие начало и окончание синтеза белка. Непосредственно молекулы ДНК не участвуют в синтезе белка.
ГЕНЕТИЧЕСКАЯ ИНФОРМАЦИЯ, содержащаяся в ДНК, сначала переписывается на молекулы мРНК. Поток информации передается так:
ДНК → РНК → Белок.
Именно в соответствии с этим принципом синтезируются все виды мРНК, тРНК и рРНК — организаторы процесса синтеза белка в клетке. Замена тимина (ДНК) на урацил и 2-дезокси-D-рибозы на D-рибозу делает невозможным существование РНК в виде двухспиральной структуры.
|
Оказалось, что в клетке двойная спираль ДНК не является достаточно жесткой и неизменной структурой. Напротив, структура ДНК достаточно динамична и легко модифицируется. Например, при репликации и транскрипции происходит разрыв водородных связей между основаниями, что сопровождается изменением структуры ДНК. Этот процесс называют плавлением.
|
Перед каждым геном или группой генов находится последовательность нуклеотидов, определяющая место, с которого начинается копирование молекул ДНК. Эта последовательность узнается ферментом РНК-полимеразой, ответственной за синтез РНК. При этом копируется одна из нитей двухспиральной ДНК. На конце генов, определяющих структуру РНК, расположены последовательности нуклеотидов, означающие конец считывания информации. Процесс синтеза РНК на матрице ДНК протекает в строгом соответствии с принципом комплементарности и называется транскрипцией. Очень важно, что РНК-полимераза узнает сигналы начала и окончания процесса транскрипции и совершенно индифферентна к последовательностям нуклеотидов между этими сигналами. Генетический код универсален, в то время как регуляторные последовательности, определяющие начало и конец транскрипции, специфичны для данного организма. Оказалось, что при транскрипции не всегда считываются гены, расположенные последовательно друг за другом: часто между двумя «нужными» генами располагается некодируемая последовательность нуклеотидов, называемая нитроном.
Транскрипция в ядрах клеток высших животных и человека протекает с очень высокой скоростью, но лишь малая часть синтезированных рРНК и мРНК выходит за пределы ядра. Оставшиеся молекулы РНК разрушаются в ядре — их время жизни не превышает 60 мин.
У высших животных существуют три типа РНК-полимераз, причем каждый из них участвует в транскрипции только одного типа.
БИОСИНТЕЗ БЕЛКА осуществляется в рибосомах — специальных органеллах клетки — с участием рРНК и тРНК на мРНК. Молекула мРНК имеет два сигнальных кодона: AUG на 51 конце (инициатор синтеза белка) и UAG на 31 конце (сигнал о завершении синтеза белка). тРНК в процессе синтеза белка играет важную роль. Ведь именно тРНК доставляют нужную аминокислоту к растущей полипептидной цепи. Важно, что присоединенная к тРНК аминокислота получает нужный запас энергии и способна самостоятельно образовывать пептидную связь. тРНК имеет последовательность нуклеотидов, комплементарную кодону мРНК, поэтому, когда тРНК соединяется с мРНК, аминокислота оказывается в месте роста поли-пептидной цепи синтезируемого белка. Этот процесс декодирования информации, заключенной в мРНК, происходит только в рибосомах. Присоединение мРНК и тРНК к определенным местам связывания обеспечивает правильное считывание информации с мРНК. Подробный механизм такого процесса до конца не выяснен тРНК узнает «свою» аминокислоту благодаря строго специфичным ферментам, называемым аминоацил-тРНК-синтетазами, которые присоединяют аминокислоты к молекуле тРНК. Каждой аминокислоте соответствует свой фермент. Сочетание «усилий» аминоацил-тРНК-синтетаз и всех видов РНК и обеспечивает синтез нужного организму белка в рибосомах.
|
|
|
|
Вирус гриппа. |
Схема полирибосомы в процессе синтеза белка. |
РИБОСОМЫ можно считать белоксинтезирующей фабрикой клетки. Размер рибосомы не превышает 30 нм, она состоит из двух частей — большой и малой.
После завершения синтеза белка рибосома обратимо распадается на две части, сигналом для этого является кодон UAG на конце мРНК. В синтезе белка занято много рибосом, которые связаны с мРНК.
Скорость синтеза белка достаточно высока — полипептидная цепь из 20 аминокислот синтезируется за 1 с, а полный синтез белка средней величины занимает 20 - 60 с.
Гормоны и витамины необходимы для функционирования живых существ. Организмы млекопитающих не способны синтезировать витамины. Витамины непосредственно участвуют в биологических реакциях, гормоны являются их регуляторами.
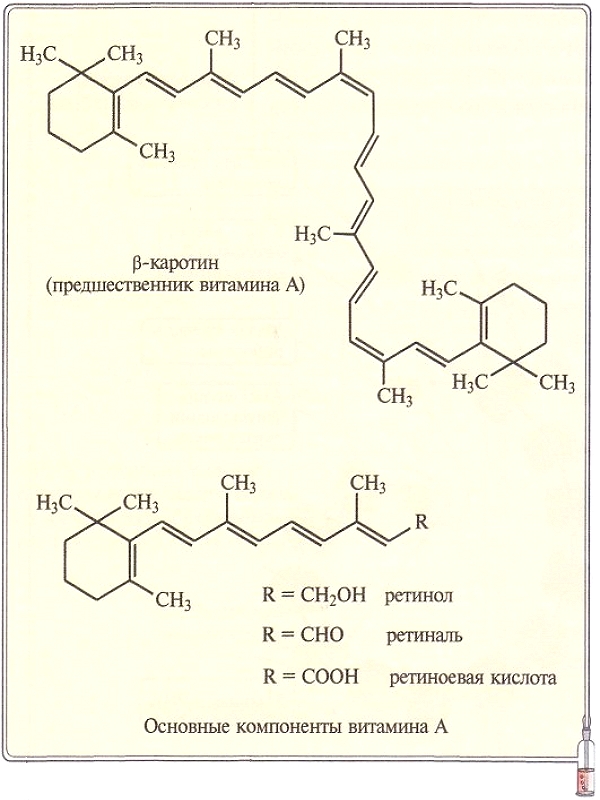
ВИТАМИНЫ (от лат. vita — «жизнь») — низкомолекулярные органические соединения разнообразного строения, необходимые для осуществления жизненно важных для организма биохимических превращений и физиологических процессов. Организмы человека и животных получают основное количество витаминов уже в готовом виде с пищей. Биологическая активность витаминов очень высока, а потребность организма в витаминах колеблется в пределах от нескольких мкг до десятков мг в сутки.
Известно около 20 различных органических соединений, которые могут быть отнесены к группе витаминов. Витамины подразделяют на две группы — водорастворимые (витамин С, витамины группы В - В1, В2, B6, В12, фолацин, пантотеновая кислота и биотин) и жирорастворимые (витамины А, D, Е и К).
Витамин С — это группа соединений, обладающих противоцинготным действием. Важнейшей среди них является аскорбиновая кислота — сильный восстановитель. Высокоорганизованные организмы утратили способность синтезировать ряд ферментов, необходимых для превращения D-глюкозы в аскорбиновую кислоту. Витамин С необходим для построения межклеточного вещества и играет роль в устойчивости организма к инфекциям и стрессам. Потребность человека в витамине С колеблется от 50 до 110 мг/сут.
|
Разнообразие продуктов питания обеспечивает снабжение организма необходимыми витаминами и минералами. |
Витамин А — группа соединений, важнейшими из которых являются ретинол, ретиналь (A1) и ретиноевая кислота (А2). В организме витамины А синтезируются из провитамина — β-каротина. Витамин А встречается только в животных тканях, особенно много его в жире и печени рыб и морских животных. Недостаток витамина А приводит к «куриной слепоте» (ухудшение зрения в сумерках) и задержке или прекращению роста костных тканей. Суточная потребность человека в витамине А составляет около 110 мкг (в пересчете на витамин А1), при этом не менее 1/3 должно поступать в виде β-каротина.
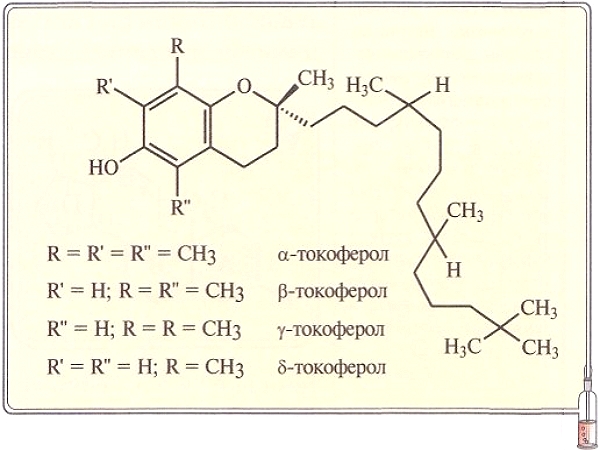
Витамины группы В. Витамин В1 — тиамин, молекула которого содержит два гетероциклических кольца — пиримидиновое и тиазольное. Большое количество витамина В1 содержится в мясе, яйцах и бобовых. Организмы человека и животных не способны синтезировать витамин В1, и они должны получать его с пищей. Витамин В1 является коферментом и участвует в окислении пировиноградной кислоты СН3 — СО — СООН (запуская последовательность биохимических реакций), которая служит источником энергии живых организмов, потребляющих кислород из воздуха. Недостаток витамина В1 приводит к истощению клеток организма и может закончиться его гибелью. Суточная потребность человека в витамине В1 составляет 1 - 3 мг. Витамин В2 (рибофлавин) — фактор роста живых организмов, один из важнейших витаминов.
|
БЕЛКОВЫЕ, ПОЛИПЕПТИДНЫЕ И СТЕРОИДНЫЕ ГОРМОНЫ |
||
| Место синтеза | Гормон | Основные регулируемые процессы |
| Щитовидная железа | Аминокислоты: тироксин и трииодтиронин | Метаболизм, потребление тканями кислорода |
| Паращитовидная железа | Полипептид кальцитонин | Метаболизм Са2+ и фосфата |
| Надпочечники, мозговой слой | Метаболиты: адреналин, норадреналин | Частота пульса, кровяное давление Освобождение липидов; сокращение и увеличение сопротивления периферических сосудов |
| Поджелудочная железа | Полипептид инсулин | Метаболизм углеводов, активация синтеза белка |
| Тимус | Полипептид тимозин | Функции половых желез |
| Нейрогипофиз | Полипептид вазопрессин | Кровяное давление, реабсорбция воды |
| Семенники | Стероид тестостерон | Развитие и функции мужских половых органов, развитие вторичных половых признаков |
Витамин В12 — группа комплексных соединений кобальта (кобаламины), которые являются коферментами различных ферментов. Их основная функция заключается в предотвращении анемий и дегенеративных изменений нервной ткани. Витамин B12 синтезируется микроорганизмами и синими водорослями. Суточная потребность человека в витамине В12 — до 2 мкг/сут.
|
Человек и позвоночные животные имеют систему желез внутренней секреции, которые осуществляют синтез гормонов. Это надпочечники, гипофиз, щитовидная железа, половые железы и др. Такие органы образуют эндокринную систему, отвечающую за синтез гормонов в организме. Некоторые гормоны действуют непосредственно в органе, где они синтезируются. Необходимо упомянуть, что некоторые гормоны синтезируются клетками слизистых оболочек желудка или кишечника, которые не относятся к клеткам эндокринной системы. Известны случаи, когда гормоны не ускоряют, а замедляют биохимические процессы.
|
Витамин Е — природные соединения, обладающие сильными восстанавливающими свойствами. Наиболее активные из них — токоферолы. Витамин Е локализуется в организме в гидрофобных участках клеточных мембран. Биологическая активность витамина Е связана с его способностью превращаться в свободный радикал с отщеплением атома Н от ОН-группы, «убивающий» в организме перекисные радикалы. В результате предотвращается нарушение структуры клеточной стенки из-за перекисного окисления липидов — гидрофобного компонента клеточной мембраны. Содержание витамина Е в растительных маслах из зародышей пшеницы составляет до 400 мг в 100 г, кукурузном и подсолнечном — до 80 мг в 100 г.
|
Применение гормонов в медицине (гормонозаменительная терапия) связано с недостатком или отсутствием в организме того или иного гормона. Гормоны применяют для усиления или подавления функций отдельной эндокринной железы. С помощью гормонов лечат некоторые виды бесплодия, их используют при лечении воспалительных процессов, некоторых форм рака и т. п. |
Витамин К — органические производные 1,4-нафтохинона. Витамины этой группы активируют процессы свертывания крови. Они распространены в пищевых продуктах и синтезируются микрофлорой кишечника. Наиболее активен витамин К2. Суточная потребность в витамине К — 0,2 —0,3 мг. Наиболее богаты витамином К шпинат, цветная и белокочанная капуста, томаты.
ГОРМОНЫ (впер, с греч. — «возбуждаю», «привожу в движение») — регуляторы биохимических процессов, биологически активные вещества, оказывающие направленное воздействие на деятельность органов и тканей организма. Они синтезируются специализированными клетками или органами. Регуляторы — гормоны обеспечивают нормальное функционирование живого организма.
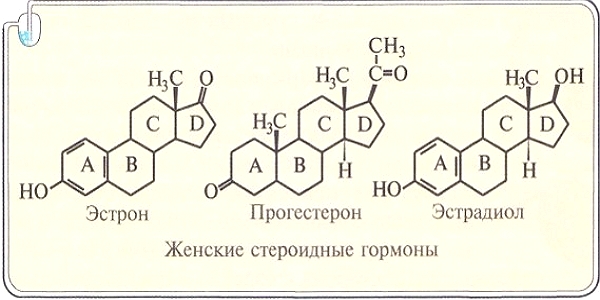 |
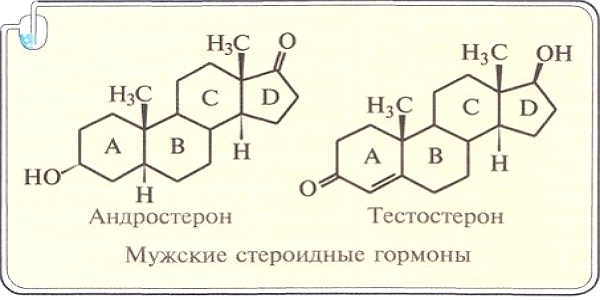 |
Механизмы, лежащие в основе действия гормонов, очень сложны.
В большинстве случаев гормоны переносятся с потоком крови до органа- или клетки-мишени, где они, взаимодействуя со специфическим клеточным рецептором, активизируют определенный процесс, протекающий в клетке.
В данном случае рецепторы — это белковые молекулы (гликопротеиды — белковые молекулы, содержащие углеводный фрагмент) или фрагменты клеточной мембраны, способные специфически связываться с определенными гормонами и передавать внутрь клетки соответствующий сигнал в результате изменения пространственной структуры рецептора. В норме концентрация гормонов в крови обычно не превышает 10-8 М, а при патологических состояниях эта величина изменяется. Данная особенность лежит в основе иммуноферментных и радиоиммунных методов диагностики.
Гормоны человека и млекопитающих животных по химическому строению обычно классифицируют на три основные группы: белки и полипептиды, стероиды и малые молекулы — синтезируемые в процессе превращения (метаболизма) аминокислот в организме. Некоторые представители гормонов приведены в таблице. Некоторые полипептидные гормоны, в том числе и инсулин, синтезируются в эндокринных железах из более крупных предшественников, называемых прогормонами.
| Основной источник гликозидных токсинов - растения. В ядрышках абрикосовых косточек присутствует цианогенный гликозид амигдалин. Он содержит синильную кислоту в связанной форме, которая освобождается в процессе ферментативного гидролиза. В наперстянке содержится ряд стероидных гликозидов, действующих на сокращения сердца. | |
 |
 |
| Так змеи «отдают» свой яд людям. Из яда змей получают ферменты и готовят лекарственные препараты. | Абрикос. |
В основе стероидных гормонов лежит скелет, состоящий из трех шестичленных колец и одного 5-членного кольца. Общий скелет стероидных гормонов показан на рисунке. Обращают внимание различия в структуре женских и мужских стероидных гормонов: кольцо А в молекулах эстрона и эстрадиола — ароматическое, в то время как у тестостерона и андростерона кольцо А — циклогексановое. В настоящее время известно около 20 000 стероидов, и около 100 используются в медицине.
Стероиды широко распространены в живом мире. Их биологические функции разнообразны. Небольшой размер молекул стероидов позволил подробно изучить их строение и стереохимию. Стероиды являются удобной моделью для исследования влияния различных факторов на стереохимию, направление и скорость химических реакций. Углеводород, соответствующий незамещенному стероиду, имеет 6 асимметрических атомов углерода. В природе существует только небольшая часть возможных диастереомеров, что объясняется высокой стереоспецифичностью биохимических реакций. Так, в природных стероидах кольца В и С всегда имеют транссочленение, кольца С и D преимущественно — транс-сочленение, а кольца А и В — как цис-, так и транс-сочленение.
ЯДЫ И ТОКСИНЫ можно характеризовать как молекулы смерти. Их действие на организм обусловлено способностью избирательно блокировать определенные процессы организма, что приводит либо к гибели, либо к серьезным нарушениям жизнеспособности организма.
Яды и токсины — это вещества высокой биологической активности и исключительной селективности. Яд — вещество или смесь веществ, попадание небольших количеств которых в живые организмы приводит к тяжелому заболеванию или гибели.
Токсинами обычно называют яды, выделяемые живыми организмами Многие яды в минимальных дозах обладают целебными свойствами и широко используются в медицинской практике.
|
|
|
|
|
Древесная гремучая змея обитает в Америке. |
Пустынный скорпион готов к нападению. |
Бледная поганка содержит смертельный яд. |
Белковые и пептидные токсины. Большую группу токсинов составляют белки и пептиды. Белками являются самые мощные из известных токсинов микробного происхождения (ботулинический, столбнячный, дифтерийный, холерный), токсины растений (рицин из клещевины и абрин из лакричника), многие яды змей, скорпионов и пауков. Среди пептидов наиболее известны токсины ядовитых грибов, пчел и морских беспозвоночных.
Бледная поганка (Amanita phalloides) содержит токсические пептиды фаллоидин и аманитин и их производные, представляющие собой бициклические системы, включающие ряд необычных аминокислот. Содержание токсинов в грибах высокое (аманитины — 0,4 мг на 1 г массы), и один съеденный гриб может вызвать смерть. Механизм биологического действия аманитина связан с ингибированием синтеза РНК. Фаллоидин необратимо изменяет морфологию клеток.
Мелиттин — основной компонент пчелиного яда. В сухом яде пчел его доля составляет 30 - 50%. Молекула токсина состоит из 26 аминокислот. Он нарушает структуру мембран и вызывает гибель клеток. Другой токсин яда пчел — апамин — действует на центральную нервную систему, блокируя работу калиевых каналов. Это один из самых небольших пептидных нейротоксинов, содержащий 18 аминокислот.
Полимерами называют сложные вещества с относительно большими молекулярными массами (порядка сотен, тысяч или даже миллионов), макромолекулы которых построены из множества повторяющихся звеньев — мономеров, связанных друг с другом ковалентными связями. Полимеры называют также высокомолекулярными соединениями (ВМС). Ориентироваться в мире макромолекул удается с помощью их классификации. Наиболее часто прибегают к классификации, в основу которой положен главный признак — химическое строение основной (главной) цепи полимера.
|
Строение полимера полибис-трифторзтоксифо-сфазена. |
Полимеры делят на два класса: гомоцепные, основные цепи которых построены из одинаковых атомов, и гетероцепные, в основной цепи которых содержатся атомы различных элементов, чаще всего углерода, азота, кремния, фосфора. В свою очередь, полимеры этих классов разделяются на подклассы и подвиды и т. д., как это представлено в классификационной таблице. Из гомоцепных наиболее распространены карбоцепные полимеры, главные цепи которых состоят только из атомов углерода. Это полиметилметакрилат, политетрафторэтилен и т. д.
Гетероцепные полимеры — полиэфиры (полиэтилентерефталат, поликарбонаты), полиамиды, мочевино-формальдегидные смолы, некоторые кремнийорганические полимеры и др. Полимеры, макромолекулы которых наряду с углеводородными группами содержат атомы других элементов, называются элементоорганическими. Отдельную группу полимеров образуют неорганические полимеры, например пластическая сера, полибис-трифторэтокси-фосфазен и т. д.
|
Схема образования структуры дендримера напоминает схему цепной реакции. |
По способу синтеза синтетические ВМС делятся на полимеры, получаемые реакцией полимеризации, реакцией поликонденсации и химической модификацией готовых макромолекул.
По поведению полимеров при нагревании их разделяют на две группы — термопластичные и термореактивные.
Термопластичные полимеры (термопласты) способны обратимо размягчаться при нагревании и затвердевать при охлаждении. При этом полимер химически не изменяется. Эта способность позволяет формовать из термопластов различные изделия.
Термореактивные полимеры (реактопласты) при нагревании необратимо превращаются в твердые неплавкие и нерастворимые продукты. Причиной этого являются серьезные структурные перестройки.
По эксплуатационным свойствам полимерные материалы разделяют на пластики, волокна и эластомеры (или резины) и т. д.
Возможности полимерной химии позволяют целенаправленно создавать полимерную цепочку различного химического строения и «архитектуры». Для этого нужно использовать одинаковые или разные «мономеры-кирпичики» и по-разному присоединять их друг к другу. Именно таким способом химики создают различные структурные формы полимерных молекул.
 |
 |
 |
 |
| Схематическое изображение различных структур полимерных молекул: | |||
| а - линейные; | б - разветвленные: | в - гребнеобразные, | г - разветвленные с многими ветвями. |
СТРУКТУРА МОЛЕКУЛ ВМС весьма разнообразна, и ориентироваться в этом помогает классификация полимеров по особенностям структуры их макромолекул. Линейные полимеры — это макромолекулы, представляющие собой достаточно длинные цепи с высокой степенью асимметрии. Если макромолекула имеет боковые ответвления от главной цепи, то полимер называют раз ветвленным.
Сетчатыми называются полимеры, построенные из длинных цепей, соединенных между собой в трехмерную сетку поперечными химическими связями — сшивками.
Некоторые разновидности пространственных структур полимеров представлены на рисунках.
Сополимерами называют полимеры, макромолекулы которых содержат несколько типов мономерных звеньев.
Если в сополимерах звенья каждого типа образуют короткие или длинные, но строго калиброванные по длине непрерывные последовательности, сменяющие друг друга в пределах макромолекулы, то такие ВМС называют блоксополимерами. Если длины последовательностей разные или, говоря более строгим языком, имеют случайное (статическое) распределение по тому или иному закону, то такие сополимеры называют статистическими.
К внутренним (неконцевым) звеньям макромолекулы одного
химического строения могут быть присоединены одна или несколько цепей другого
строения. Такие сополимеры называются привитыми.
Полимеры образуются в результате взаимодействия и соединения друг с другом одинаковых или разных малых молекул мономеров, которые являются низкомолекулярными веществами. Число мономерных звеньев в одной макромолекуле называют степенью полимеризации.
 |
 |
| Промышленная установка по производству полиэтилена низкой плотности. | |
СУЩЕСТВУЮТ ДВЕ РЕАКЦИИ, приводящие к образованию полимеров. Первая — присоединительная полимеризация, ее часто называют просто полимеризацией, и вторая — поликонденсация. Присоединительной полимеризацией называется реакция, в которой мономеры присоединяются друг к другу посредством ковалентных связей без потери каких-либо атомов. Продуктом реакции является только полимер, и он имеет ту же химическую формулу, что и мономер. Поликонденсацией называют реакцию синтеза полимера, в которой мономеры образуют полимер с выделением низкомолекулярных соединений, таких как вода, аммиак, галогеноводород и т. п. При этом состав элементарного звена отличается от состава исходного мономера. Полимеризация характерна для соединений с кратными (двойными или тройными) связями. В реакции поликонденсации участвуют низкомолекулярные вещества, имеющие две или более функциональных групп.
При химической модификации полимеров в их структуру вводят необходимые группы, используя соответствующие реакции органической химии. Такой способ получения полимеров используется реже, например, в производстве ионообменных смол.
Кинетика протекания реакций с участием высокомолекулярных реагентов, постоянно образующихся в результате роста полимерной цепи, описывается теми же уравнениями, что и кинетика низкомолекулярных реакций, при введении допущений П. Дж. Флори: реакционная способность обеих функциональных групп молекулы мономера одинакова; реакционная способность функциональной группы не зависит от того, прореагировала или нет другая функциональная группа мономера; длина цепи полимера не влияет на реакционную способность концевой функциональной группы. □
|
Во время 1-й мировой войны союзники перекрыли пути морской доставки в Германию натурального каучука. Приходилось получать полимер искусственным путем, и это была одна из первых попыток промышленного производства полимерных материалов. Заполненные жидким мономером стеклянные бутыли подвергались воздействию света в течение трех месяцев.
Промышленная установка для проведения полимеризации. |
ПОЛИКОНДЕНСАЦИЯ — это образование простых и сложных эфиров, амидной связи и др. Мономерное звено полимера, полученного с их помощью, отличается по химическому составу от исходных веществ. Для осуществления поликонденсации молекулы мономеров должны обладать по крайней мере двумя реакционноспособными группами (например, -ОН, -СООН, -МН2 и др.).
Функциональность оказывает существенное влияние на строение и свойства получаемого полимера. В самом деле, при соединении двух монофункциональных исходных веществ, очевидно, может получиться только димер. Бифункциональные же мономеры при взаимодействии образуют соединения, обладающие двумя функциональными группами, способными снова вступать во взаимодействие с новыми мономерами.
Поликонденсацией получают, например:
nH2N - R - NH2 + пНООС - R' - СООН → H(NH - R - NH - CO - R' - CO)nOH + (2n-1)H2О
или сложные полиэфиры из двухатомных спиртов и дикарбоновых кислот:
nHO - R - OH + nHOOC - R' - COOH → H(О - R - О - CО - R' - CО)nОH + (2n - 1)Н2О.
Если мономеры имеют больше двух функциональных групп да еще вводят специальные реагенты (отвердители), образующие поперечные химические сшивки, получаются полимеры пространственного строения.
Примером реакции поликонденсации с образованием пространственного полимера является реакция взаимодействия фенола С6Н5ОН с формальдегидом СН2О в присутствии кислот (НСI и др.) или щелочей (NaOH, NH4OH) в качестве катализаторов. При этом образуются так называемые фенолформальдегидные смолы:
Когда полимеризация формальдегида проходит при избыточном содержании фенола, то, как правило, образуются линейные полимеры — так называемая новолачная смола:
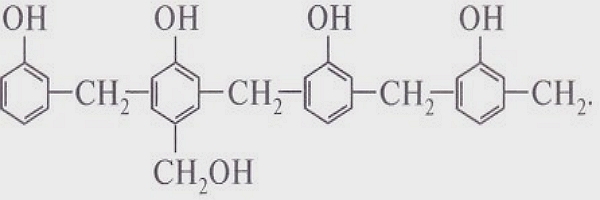
Смола используется для приготовления лаков. Если полимеризация идет при избытке формальдегида, то образуется полимер сложной пространственной структуры. Реакция поликонденсации в данном случае сопровождается выделением воды. При нагревании фенолформальдегидные смолы сначала размягчаются, а затем затвердевают (особенно в присутствии катализаторов). Из этих смол изготавливают ценные пластмассы — фенопласты.
|
Фенолформальдегидные смолы смешивают с различными
наполнителями (древесной мукой, асбестом, графитом и др.),
пластификаторами, красителями - и из полученной массы методом
горячего прессования формуют различные изделия. Фенопласты -
термореактивные полимеры - не плавятся при нагревании. На их основе
получают легкие пористые материалы - пенопласты.
|
ПОЛИМЕРИЗАЦИЯ. С реакциями полимеризации химики сталкивались достаточно давно. Еще в 1867 г. А. М. Бутлеров осуществил полимеризацию изобутилена и бутилена. Было установлено, что непредельные соединения вообще относительно легко вступают в реакцию полимеризации. Так, полимеризация этилена происходит в результате разрыва π-связей под действием так называемых инициаторов. Они присоединяются к молекуле мономера, образуя на нем активный центр, к которому может присоединиться очередной мономер. Инициирующая частица остается ковалентно связанной с одним из концов растущей полимерной молекулы до тех пор, пока не прекратится рост цепочки в результате обрыва или передачи цепи. В зависимости от природы инициаторов — радикалы (R*), катионы (R+) и анионы (R-) — реакции полимеризации разделяют на радикальные, катионные и анионные.
Радикальная полимеризация. При полимеризации по радикальному механизму реакция начинается под действием радикалов — частиц с неспаренными электронами, которые образуются в результате гемолитического разрыва химической связи: I + R : R = 2R*, где I — инициатор, R* — радикал.
Радикалы образуются в результате действия света (фотохимический способ инициирования), нагревания (термический) и радиации (радиационный). Реакция полимеризации начинается и при соударении мономера со свободным радикалом, источником которого служит химическое соединение — инициатор (химический способ инициирования). Пример химического инициирования — распад перекисей, например перекиси бензоила, при легком нагревании:
(С6Н5СОО)2 → 2С6Н5СОО* → С6Н5СОО* + *С6Н5 + СО2.
В результате атаки мономера радикалом начинается рост полимерной цепи:
C6H5COO* + Н2С = СНХ → С6Н5СОО-СН2 - СНХ* и далее
С6Н5СОО - СН2 - СНХ* + nН2С = СНХ → C6H5COO - (СН2 - СНХ)n - СН2 - СНХ*.
Начальную стадию полимеризации называют инициированием. Если встретятся два радикала, они рекомбинируют и произойдет обрыв цепи:
R1 + R2 → R1R2.
Рост цепочки может прекратиться также по механизму передачи цепи, когда растущий макрорадикал, реагируя с другой молекулой, превращает ее в радикал:
R1 - CH2 - CH2 + АН → R1 - CH2- CH3 + А.
В зависимости от давления, температуры, присутствия дополнительных веществ и т. д. реакция полимеризации одного и того же вещества может осуществляться либо по радикальному механизму, либо по ионному.
| В 1910 г. русский химик С. В. Лебедев (1874 - 1934) впервые полупил каучукоподобный продукт полимеризацией бутадиена. В 1926 - 1928 гг. был разработан признанный лучшим метод получения из спирта дивинила с последующей полимеризацией его на металлическом натрии. В 1932 г. в нашей стране было создано промышленное производство синтетического каучука таким методом. | |
 |
 |
| Добыча природного каучука - процесс трудоемкий. | |
Ионная полимеризация. В реакциях этого типа активными центрами полимеризации являются ионы, которые образуются из молекул мономеров под действием катализаторов, в результате чего синтез полимерной молекулы протекает быстрее, чем при радикальной полимеризации. Возможно получение полимеров с большими молекулярными массами, а сама специфика ионной реакции позволяет контролировать микроструктуру полимера.
Для ионной полимеризации характерны те же этапы, что и для радикальной: инициирование, рост цепи и ее обрыв.
Катализаторами в катионной полимеризации являются вещества — акцепторы электронов (AlCl3, ТiСl3, BF3, FеСl3, SnCl4 и др.). Для образования активного комплекса необходимо присутствие сокатализатора — воды, кислот, эфиров и др. Активный комплекс, реагируя с молекулой мономера, присоединяется к нему. При этом на мономере образуется карбкатион — активный центр, дающий начало полимерной цепи:
ВF3 + Н2О → [ВF3ОН]-Н+,
[BF3OH]-H+ + CH2 = CH - R → СН3 - СН+ R[ВF3ОН]-.
Образовавшийся ион затем реагирует со следующей молекулой, и, таким образом, происходит рост полимерной цепочки:
СН3 - СН+R[ВF3ОН]- + СН3 = CHR → Н - [СН2 - CHR - ] - СН2 - СН+R[BF3OH]-.
Поскольку карбкатион с противоионом всегда остается на конце растущей цепи, то присоединение возможно только по типу «голова к хвосту», и полимерная цепь имеет регулярное строение.
|
Радикальной полимеризацией в промышленности получают большинство наиболее важных линейных гомополимеров: поливинилхлорид, поливинилацетат, полиэтилен, полиметилметакрилат, полистирол и т. д. Если исключить встречу аниона на конце растущей цепочки с другими веществами (например, примесями), которые способны его «убить», то он будет продолжать «жить» практически неограниченно долго. По аналогии с живой природой в этом случае анионную полимеризацию называют «живущей полимеризацией». Она имеет важное практическое значение при синтезе блоксополимеров и звездочных полимеров. При синтезе блоксополимеров сначала происходит полимеризация одного мономера, а затем другого. Так можно получить ди-, три- ... блоксо-полимеры.
Промышленная установка для проведения полимеризации. |
Цепь обрывается при разрушении ионной пары, в данном случае с отщеплением воды:
-СН2 - СН+R[ВF3ОН]- → - СН = СН - R + ВF3 + Н2О.
При передаче активного центра на мономер цепь обрывается, и полимеризация идет по новому активному центру:
- СН2 - СН+R[ВF3ОН]- + СН2 = СНR → - CH = CHR + СНз - СН+R[ВF3ОН]-.
Катализаторами анионной полимеризации являются вещества — доноры электронов (щелочные металлы, их гидриды, амиды и др.). При анионной полимеризации наибольшую активность проявляют мономеры с электроноакцепторными заместителями, такие как акрилонитрил, стирол и т. п. Процесс начинается с образования активного центра:
и затем происходит рост цепи:
NH2 - (СН2 - CHR)n+1СН2 - CHRNa+.
Действие щелочных металлов как инициаторов полимеризации начинается с образования ион-радикалов, рекомбинация которых приводит к получению димера с двумя анионными центрами по концам, каждый из которых является началом роста полимерной цепи:
Если жестко контролировать ход реакции, «подпитывая» реактор мономерами, полимерная цепь будет расти неограниченно, и ее длина будет зависеть только от количества добавляемого мономера.
СТЕРЕОСПЕЦИФИЧЕСКАЯ ПОЛИМЕРИЗАЦИЯ. Сегодня химики умеют получать синтетические полимеры с заданной пространственной микроструктурой, или, как еще говорят, стереорегулярной структурой.

Для этой цели служат стереоспецифические катализаторы. Пальма первенства в открытии таких катализаторов принадлежит двум ученым — К. Циглеру и Дж. Натту; за их открытия им были присуждены Нобелевские премии по химии.
|
Увеличение (на 2 - 4 порядка!) активности металлоценовых катализаторов состава (С2Н5)2МСl2 (М = Ti, Zr, Hf) при
использовании в качестве сокатализатора полиметилалюмоксана,
открытое Каминским и Синном, активизировало работы по улучшению
свойств полиолефинов. Данные каталитические системы позволяют
получать поли меры с высокой стереорегулярностью, узким ММР,
сополимеры с однородным статистическим распределением мономера в
цепи. Таким образом, удается улучшить свойства конечного полимера.
Позднее катализаторы Циглера - Напа стали использовать и для синтеза
других полимеров, например цис-1,4-полиизопрена и бутадиенового
каучука. |
Стереоспецифические катализаторы представляют собой комплексы, которые образуют металлоорганические соединения металлов I - III групп с хлоридами переходных металлов IV - VIII групп. Таким катализатором, в частности, является комплекс триэтилалюминия и хлорида титана
(С2Н5)3Аl/ТiСl3.
На начальной стадии полимеризации происходит образование π-комплекса между мономером и титаном. Затем этот комплекс перегруппировывается, мономер внедряется в его структуру, и, наконец, структура комплекса восстанавливается:
Молекула мономера внедряется непосредственно в каталитический комплекс, и растущая цепь как бы отодвигается от катализатора. При этом обеспечивается не только химически регулярное строение по типу «голова к хвосту» (что характерно для ионной полимеризации), но и заданное пространственное расположение каждого мономерного звена.
СОПОЛИМЕРИЗАЦИЯ. Сополимеризацией называется процесс образования полимера из двух или более различных мономеров; при этом возможно получение сополимеров разных типов: регулярных и нерегулярных.
Процесс «замораживания» движения сегментов мономерных звеньев при охлаждении предварительно нагретого полимера называется стеклованием. Нагретый выше температуры стеклования полимер становится высокоэластичным.
| Хлопок состоит из целлюлозы. Температура стеклования целлюлозы составляет 225° С, и при обычных условиях движение макромолекул целлюлозы «заморожено», ее волокна находятся в застеклованном состоянии. Но целлюлоза легко поглощает влагу, поэтому хлопчатобумажная ткань прекрасно впитывает пот. Влага, проникая между молекулами целлюлозы, разрыхляет ее структуру, ослабляя межцепное взаимодействие. |  |
ОБЫЧНЫЕ СИЛИКАТНЫЕ СТЕКЛА (оконные) представляют собой материал, состоящий из частично разветвленных силикатных цепей. Разветвленные цепи не могут уложиться так, чтобы образовалась упорядоченная структура, поэтому стекло — аморфное или «бесструктурное» вещество. Тепловое движение его молекул при комнатной температуре недостаточно интенсивно для того, чтобы заставить двигаться друг относительно друга отдельные сегменты, и стекло выглядит как твердое вещество.
Со временем и стекла начинают «течь» под тяжестью собственного веса. Так, очень старые оконные стекла становятся немного толще книзу. А если стекло нагреть, оно размягчается и из него стеклодув может выдуть изделие самой причудливой формы. Процесс размягчения стекла не похож на плавление. При плавлении разрушается кристаллическая решетка — вещество становится аморфным, а силикатное стекло — не кристаллический, а аморфный материал.
В процессе нагревания аморфного полимера тепловое движение в нем становится более интенсивным, в него вовлекаются все большие участки цепей. При определенной температуре достаточную подвижность приобретают целые сегменты цепей. Расталкивая соседей, сегменты могут вовлекать их в совместное, или кооперативное, движение. Такое кооперативное движение сегментов возможно после преодоления некоего энергетического барьера, которому соответствует определенная температура.
При охлаждении движение постепенно «замораживается», и в конце концов перестают двигаться даже отдельные мономерные звенья. Впервые это явление было обнаружено в стеклах, поэтому и процесс получил название стеклования. Температура, при которой происходит «замораживание» сегментальной подвижности, называется температурой стеклования. Это важная характеристика полимеров.
Нагретый выше температуры стеклования аморфный полимер размягчается, переходя в новое физическое состояние — высокоэластическое. В этом состоянии полимер проявляет одно из интереснейших своих свойств — способность к большим деформациям при небольшой нагрузке.
В кристаллизующихся полимерах обязательно имеются аморфные прослойки. Для таких полимеров характерны и процесс плавления кристаллической фазы, и процесс размягчения аморфной.
|
Для того чтобы спрессовать достаточно жесткий
поливинилхлорид, в него добавляют пластификаторы - фталевую,
лимонную кислоты и др. Клеенки из пластифицированного ПВХ пахнут
пластификатором, который испаряется из полимера. Поэтому в качестве
пластификатора лучше использовать менее летучие вещества.
|
Температура стеклования для различных полимеров меняется в достаточно широком диапазоне. Она зависит как от жесткости цепи, так и от взаимодействия между макромолекулами. Полимер с жесткими макромолекулами необходимо нагреть до более высокой температуры, чтобы он расстекловался.
В полимерах процесс стеклования всегда происходит не при какой-то определенной температуре, а в температурном интервале, и за температуру стеклования принимают некую среднюю температуру.
Все процессы, происходящие в полимерах при нагревании или охлаждении (такие, как стеклование, плавление и т. п.), протекают в некотором температурном интервале.
Для того чтобы снизить температуру стеклования полимера, в него добавляют пластификатор.
При достаточно высоких температурах относительные перемещения цепей настолько облегчаются, что полимер может начать течь. Этот процесс не похож на плавление кристаллов, так как аморфные полимеры не имеют кристаллического строения. При нагревании выше температуры истинного течения аморфный полимер переходит из высокоэластического состояния в вязкотекучее. Температуру, при которой происходит этот переход, называют температурой течения.
Атактический полистирол — типичный представитель аморфных полимеров. Он имеет температуру стеклования 100° С, а выше 180° С начинает течь.
Каждое фазовое состояние характеризуется степенью упорядоченности расположения молекул в пространстве.
|
Дифракция на молекулах и атомах вещества требует длины волны порядка 10-10 м. Такую длину волны имеет рентгеновское излучение, и при определенных условиях можно наблюдать рентгеновскую дифракцию на кристаллической решетке твердых тел. По положению максимумов на дифракционной картине определяют расстояние между молекулами и атомами в кристалле. Метод изучения рентгеновской дифракции называется рентгено-структурным анализом.
|
МАКСИМАЛЬНЫЙ ПОРЯДОК И СИММЕТРИЯ царят в кристаллах, где они сохраняются на больших, сравнительно с расстояниями между молекулами, расстояниях. В жидкости молекулы практически разупорядочены. Здесь, как принято говорить, существует только ближний порядок: элементы порядка заметны лишь на расстояниях, сравнимых с расстояниями между молекулами. В газах и этого подобия порядка нельзя обнаружить: молекулы хаотично «путешествуют» в пространстве.
Все вышесказанное относится к основным фазовым состояниям — кристаллическому, жидкому, или аморфному (реже используют термин «жидкое»), и газообразному. Именно они характерны для большинства простых веществ и малых молекул. Полимеры в принципе не могут существовать в газообразном состоянии. Макромолекулы успевают разрушиться, деструктировать, раньше, чем мы их смогли бы нагреть до необходимой, гипотетической температуры перехода в газообразное состояние. При определенных температурах полимеры могут течь, как жидкости с высокой вязкостью, поэтому это аморфное фазовое состояние полимеров иногда называют вязкотекучим или жидкоподобным. Оказалось, что в таком состоянии макромолекулы принимают конформацию статистического клубка — так же, как в растворе.
О том, как молекулы «упаковываются» в кристаллических структурах и какие геометрические формы могут иметь кристаллы, вы узнали из раздела, посвященного кристаллохимии. Совершенно невозможно вообразить, как длинные полимерные молекулы могут образовать молекулярный кристалл. Соотношение длины макромолекулы и ее поперечных размеров может достигать очень больших величин. Неужели такие макромолекулы способны подстроиться друг к друг так, чтобы образовался кристалл, подобно молекулам низкомолекулярных веществ? Ведь один из размеров такого кристалла должен оказаться равным контурной длине макромолекулы? Ответить на этот вопрос нам поможет эксперимент. Полиэтилен и другие полимеры способны кристаллизоваться. Размер их кристаллов составляет ~10 - 20 нм, хотя длина выпрямленной макромолекулы гораздо больше (см. выше). Противоречие было снято Фишером, Келлером и Тиллом. Выдвинутая ими гипотеза о складывании полимерной молекулы является одной из самых революционных и фундаментальных идей полимерной науки. Впоследствии она была надежно подтверждена.
Оказывается, макромолекула может складываться сама на себя, образуя кристаллические области полимера — так называемые кристаллиты. Если макромолекула достаточно длинная, то она проходит через несколько кристаллитов. Эти проходные цепи и петли на поверхности кристаллитов образуют некристаллические, аморфные области. Таким образом, кристаллизующийся полимер не является полностью кристаллическим веществом. В редких случаях при специальных условиях удается вырастить из полимера монокристалл, похожий на кристалл-гигант низкомолекулярного вещества. Но его структура менее совершенна и имеет дефекты. Роль дефектов играют петли сложенных макромолекул и их концы. В случае полиэтилена в одну такую петлю входят порядка 10 мономерных звеньев, которые не попадают в упорядоченную, кристаллическую часть полимера.
| Частично кристаллические полимеры, такие как полиэтилен и полипропилен, физически сшиты посредством кристаллических областей, тогда как их аморфные области подобны резине вследствие низкой температуры стеклования. | ||
 |
 |
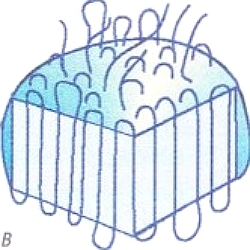 |
| Схематические изображения аморфного (а) и кристаллического (б) состояний полимеров, а также складки кристаллизующегося полимера (в). | ||
ЖИДКОКРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ ПОЛИМЕРОВ. Сейчас хорошо известно, что некоторые вещества, в том числе полимеры, способны находиться в состоянии, являющемся промежуточным между кристаллическим и жидким, Оно характеризуется неравномерностью (анизотропией) свойств и отсутствием трехмерного дальнего порядка в расположении молекул в пространстве. Это — жидкокристаллическое (ЖК) состояние. Его называют также мезоморфным или мезофазой (от греческого «мезо» — «промежуточный»).
|
Блоксополимеры - пример самоорганизующихся полимерных систем. При смешении двух сортов макромолекул (назовем их Am и Вn) происходит их расслоение. Каждый полимер стремится сохранить макроконформацию клубка. И клубки полимера Аm не могут полностью перепутаться с клубками полимера Вn и стремятся выделиться В отдельную фазу. Но если макромолекула состоит из блоков Аm и Вn, то разделиться им уже не представляется возможным - они связаны между собой химической связью Аm-Вn. Блоки вынуждены упаковываться в слои. Если размеры блоков Аm и Вn близки, то полимер имеет ламеллярную (слоевую) структуру. Если размеры блоков Вn и Аm сильно отличаются, то полимер либо сохраняет ламеллярную структуру за счет растяжения цепей Аm, либо переходит в состояние с другой структурой.
Структурные разновидности низкомолекулярных ЖК. |
Картина равновесных фазовых состояний, занимающих промежуточное положение между истинно кристаллическим и истинно аморфным, весьма многообразна. Рассмотрим простую аналогию. Если разбросать произвольным образом на столе достаточно большое количество карандашей, они окажутся направленными произвольно во все стороны. Если вы будете аккуратно сгребать их, то вы придете к ситуации, когда карандаши соприкасаются друг с другом, но их ориентация все еще беспорядочна. Можно попытаться усилить еще более их соприкосновение, уменьшив при этом доступное пространство, однако теперь становится невозможным сохранить беспорядок в их ориентации. В конце концов окажется, что все они сориентируются в одном направлении.

Подобным образом ведут себя молекулы жесткоцепных полимеров в растворе. Жесткие макромолекулы, похожие на карандаши, не могут свернуться в клубок. Если начать с сильно разбавленного раствора, то они будут ориентированы в нем совершенно беспорядочно. Но если увеличивать концентрацию полимерных молекул в растворе, то при определенном ее значении стержни-палочки произвольным образом примут некую преимущественную ориентацию.
Возникновение такого рода ориентационного порядка возможно и в низкомолекулярных веществах, если их молекулы, подобно макромолекулам, обладают анизотропией формы. Мезоморфное состояние, которое характеризуется только что описанным ориентационным порядком в пространственном расположении палочкообразных молекул, называют нематическим. Есть и другие разновидности ЖК состояния, например: смектические жидкие кристаллы (более десятка подвидов), холестерические и т. д. В смектиках молекулы упаковываются в слои, в которых может наблюдаться дальний порядок, но его может и не быть. Холестерик похож на нематик тем, что у него молекулы в мономолекулярном слое упакованы так же, как в нематике, т. е. имеют преимущественную ориентацию, только внутри каждого слоя существует свое направление преимущественной ориентации молекул. От слоя к слою вектор ориентации поворачивается, закручиваясь в спираль.
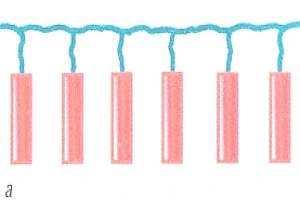 |
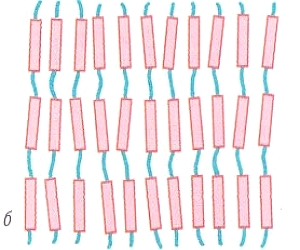 |
 |
|
Особенности структуры полимерных ЖК: а - простейшие варианты построения полимерных цепей с жесткими и гибкими фрагментами; б - образование смектического порядка; в - двухмерная решетка полимерного ЖК с гибкими цепями. |
||
В образовании ЖК порядка в полимерах могут участвовать как целая макромолекула, так и ее части. Как сказано выше, нематический порядок в полимерах может реализоваться путем ориентации всей макромолекулы. Жесткие фрагменты (мезогены), присоединенные к основной цепи или прикрепленные к ней через гибкие развязки, могут укладываться в смектические слои или образовывать только ориентационный нематический порядок. Такие боковые мезогены, прикрепленные гибкой развязкой к основной цепи, способны закручиваться в спираль хирального жидкого кристалла.
|
Образование областей (доменов) в двухблочном сополимере Аm-Вn при разном соотношении размеров блоков Am и Вn. |
Макромолекула может потерять дальний порядок вдоль цепочки, но сохранить порядок в упаковке остовов цепей в перпендикулярном направлении, тогда в полимерах наблюдается особый вид мезофазы — конформационно-разупорядоченные кристаллы. Мир ЖК полимеров очень разнообразен!
Мезоморфные системы представляют собой не что
иное, как самоорганизующиеся системы.
Класс полимеров, называемых полидиенами, обладает характерным свойством, которое выделяет его из всех материалов. Это свойство — эластичность.
|
По данным археологических находок, еще в XI в. индейские племена Центральной Америки изготавливали из «эластичной смолы» мячи, отличавшиеся поразительной прыгучестью. Позднее подобный мяч привез из экспедиции на острова Кубу и Гаити в Испанию знаменитый Колумб. Но ему не было известно происхождение смолы. Только много лет спустя узнали, что это был натуральный каучук, который получали из сока дерева гевеи (на языке индейцев «плачущее дерево»). Гуттаперча - природный полимер - разновидность изопрена, отличающийся от натурального каучука конфигурацией молекулы:
|
Конечно, речь идет о резине. Резина способна подвергаться большим деформациям, причем обратимым. Если растянуть узкий кусок резиновой ленты в несколько раз, то после снятия нагрузки она практически восстановит свои размеры и форму. Простым изменением расстояния между атомами под действием приложенной нагрузки, как это имеет место в случае твердых кристаллических низкомолекулярных веществ, объяснить десятикратное увеличение в размере невозможно.
При низкой температуре резина — хрупкое вещество. При температуре выше температуры стеклования она находится в так называемом высокоэластическом состоянии. В этом состоянии ее можно деформировать, растягивая до 10 раз (1000%). При снятии нагрузки резина восстанавливает свою форму, т. е. деформация резины упругая и обратимая.
У металлов величина возможной обратимой деформации не превышает 1%. В данном случае упругая деформация связана с обратимым изменением расстояний между атомами или молекулами в узлах кристаллической решетки, взаимодействие между которыми препятствует деформации, поэтому и происходит восстановление формы материала при снятии нагрузки. Невозможно представить себе, чтобы подобный механизм мог бы работать при деформации материала до 1000%, как это наблюдается в поведении резины.
Есть и еще одна особенность: обычно модуль упругости неполимерных кристаллических твердых тел уменьшается с ростом температуры. Иными словами, чем выше температуpa, тем легче деформировать такое тело. На этом основаны процессы горячей обработки металлов. Для резины, наоборот, модуль упругости возрастает с повышением температуры, и растянуть горячую резину становится труднее. Поведение резины, отличающее ее от других твердых веществ, обусловлено особенностями ее молекулярного строения.
|
Сам по себе сырой каучук не пригоден для широкого
использования. Его необходимо превратить в резину -
вулканизированный каучук. Для этого в него вводят различные добавки
- пластификаторы, антиоксиданты, пигменты и др. Резину человек
научился получать всего лишь около 150 лет тому назад. |
В природе есть вещества, у которых модуль упругости также увеличивается при нагревании. Это газы. Если заполнить идеальным газом цилиндрический сосуд с легким поршнем, то молекулы газа будут ударяться беспорядочно о стенки сосуда и поршня, создавая постоянное воздействие, давление. При нагревании средняя скорость молекул газа, а следовательно, и импульс увеличиваются, и они действуют на поршень с большей силой, а значит, и давлением, если, конечно, объем газа остается постоянным. При сжатии газа необходимо преодолеть толчки молекул о поршень. Что-то похожее происходит и с резиной. Если растянуть за концы макромолекулу и отпустить ее, то в результате теплового движения звеньев она снова примет форму гауссова клубка. Растягивая резину, необходимо преодолеть стремление полимерной молекулы свернуться в клубок. С повышением температуры интенсивность теплового движения возрастает, и нужно применить большее усилие для того, чтобы преодолеть противодействие растяжению.
Кроме того, растяжение цепных молекул переводит их в менее вероятное состояние. Сжатый газ тоже находится в менее вероятном состоянии. Если снять груз с поршня, то газ возвращается в обычное состояние — ведь с увеличением объема возрастает число способов размещения неизменившегося числа молекул в сосуде, а значит, и степень беспорядка, связанная с большими возможностями размещения молекул.
Резина — вулканизированный каучук. При вулканизации сера присоединяется к двойным связям каучука, образуя дисульфидные мостики, играющие роль химических сшивок. Они превращают каучук в сетчатый полимер, представляющий собой огромную трехмерную макромолекулу. Участки между сшивками, если они недостаточно частые, ведут себя как отдельные макромолекулы. И к ним можно применить рассуждения о деформации отдельной макромолекулы.
Таким образом, поведение гибкой полимерной цепочки связано с эластичностью резины. К эластомерам относятся не только полимеры, полученные на основе изопрена или бутадиена, но и все материалы, которые обладают в режиме эксплуатации свойством высокоэластичности.
В повседневной жизни нас окружают полимерные материалы, которые мы называем просто пластмассами.
Пластмассы — это полимерные материалы, которые в процессе переработки находятся в высокоэластическом или высоковязком состоянии, а при эксплуатации — в стеклообразном или частично кристаллическом. К пластмассам относятся полиэтилен, лавсан, нейлон, тефлон и многие другие.
|
Текстильные волокна, используемые для производства пряжи, делятся на натуральные и химические. Натуральные волокна изготавливают из растительного сырья, шелка и шерсти, хлопка. Химические волокна подразделяют на искусственные, получаемые переработкой природных веществ, и синтетические, изготавливаемые из синтезированных полимеров. |
ТВЕРДОСТЬ ПОЛИМЕРОВ. Рассчитаем модуль упругости полиэтилена. Чтобы оценить теоретически эту величину, просто воспользуемся данными о модуле упругости алмаза, полагая, что он дает информацию о деформации связи С - С. На рисунке представлены структуры алмаза и полиэтилена. Площадь сечения атома углерода ~0,05 нм2, а полиэтиленовой цепи — 0,18 нм2. Модуль упругости кристалла алмаза равен ~1200 ГПа. Значит, модуль упругости полиэтиленовой цепочки должен быть во столько раз меньше модуля алмаза, во сколько площадь сечения полиэтиленовой молекулы больше площади сечения атома углерода, из которого построена решетка алмаза. Подсчитаем его: Е = 1200 х 0,05/0,18 ≈ 330 ГПа. Более точные расчеты дают значение 340 ГПа для направления вдоль цепочки и ЗГПа — поперек. Но модуль упругости изделий из полиэтилена не превышает 1ГПа! Почему же так отличаются теоретические и экспериментальные значения этой величины?
В расплаве все молекулы полиэтилена перепутаны, и каждая из них имеет конформацию статистического клубка. Кристаллизация происходит очень быстро, макромолекулы не могут выстроиться параллельно друг другу (им мешает их собственная длина), и они складываются сами на себя. Как результат, отдельные области полимера содержат кристаллические образования (кристаллиты), между которыми имеются аморфные прослойки, связанные с кристаллитами так называемыми проходными цепями. В целом по всему материалу цепочки ориентированы беспорядочно, и полиэтилен является изотропным полимером. Именно поэтому модуль упругости обычного полиэтилена гораздо меньше его расчетного значения.
ПОЛИМЕРНЫЕ ВОЛОКНА. Чтобы нагрузка распределялась вдоль и равномерно на все полимерные цепи, складок не должно быть, тогда все макромолекулы будут выстроены в одном направлении. Такой структурой обладают полимерные волокна. Полимерные цепи в них преимущественно ориентированы вдоль оси волокна, что характерно для анизотропной структуры.
|
Волокна, получаемые из полиамидных смол (капрон,
нейлон), по некоторым свойствам превосходят натуральный шелк. Из них
вырабатывают красивые прочные ткани и трикотаж.
Схематическое изображение структуры кристаллического (а) и аморфного волокна (6). |
ПОЛУЧЕНИЕ ВОЛОКОН. Сначала полимер переводят в вязкотекучее состояние, нагревая его до температуры выше температуры плавления. Если полимер невозможно расплавить, его растворяют и получают так называемый прядильный раствор. Расплав (или раствор) продавливают через мелкие отверстия — фильеры, так, чтобы на выходе получились длинные нити. Из фильер полимер попадает в среду, где происходит его затвердевание в виде тонких волокон.
В основном для этого используют холодный воздух. Если волокна получают в растворе, то полимер сушат сразу после выхода из фильер для удаления растворителя. Так происходит формование волокна.
Но чтобы получить высокую степень ориентации макромолекул в волокне и высокую степень его анизотропии, волокна подвергают дополнительной ориентационной вытяжке при температуре выше точки стеклования полимера. Другой важной характеристикой механических свойств полимеров является прочность. Она определяется как напряжение (сила на единицу площади), которое может выдержать материал в момент начала разрушения.
При разрушении полимера разрываются валентные
(внутримолекулярные) связи, а в результате разрыва межмолекулярных связей цепи
начинают проскальзывать друг относительно друга. Очевидно, в ориентированном
состоянии вдоль параллельно выстроенных макромолекул прочность выше, нежели
поперек. Вот почему полимеры получают в ориентированном состоянии, чтобы
добиться не только высокого модуля, но и прочности. Правда, различные дефекты на
поверхности (трещины) и в объеме (полости) снижают теоретическую прочность вдоль
оси макромолекул, в которую вносят вклад силы внутри- и межмолекулярного
взаимодействия.
Полимерные материалы все чаще заменяют традиционные: металл, дерево, бетон, стекло. Важнейшими и наиболее употребляемыми полимерами являются: полиэтилен, полистирол, полифенилентерефталамид и другие.
|
Полиэтилен используют для производства пленок различного назначения. Он легко поддается механической обработке. Изделия из него в основном получают литьем или горячим прессованием. Из полиэтилена с величиной ММ более 1 000 000 изготавливают протезы суставов.
|
Полиэтилен получают полимеризацией этилена:
пСН2 = СН → [-СН2 - СН2-].
Он является рекордсменом среди синтетических полимеров по объему производства.
Полистирол — полимер, который при комнатной температуре находится в стеклообразном состоянии. Он образуется при полимеризации стирола в виде прозрачной стеклообразной массы:
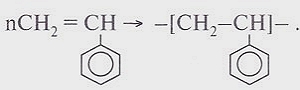
Из полистирола изготавливают специальную лабораторную посуду, пуговицы, гребни, электроизоляторы и т. д.
Полифенилентерефталамид — полимер, структура которого характеризуется высокой параллелизацией достаточно жестких макромолекул:
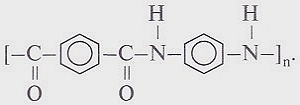
Волокна из этого полимера обладают очень высокими механическими характеристиками и используются, в частности, для изготовления бронежилетов.
Полиэфиры часто получают как сополимеры, образованные при поликонденсации мономеров — диолов и дикарбоновых кислот.
Полиэтилентерефталат — полиэфир, в молекуле которого многократно повторяется группировка сложного эфира. В нашей стране этот полимер выпускают под названием лавсан, а за рубежом — терилен и дакрон. Из него изготавливают прочное, несминаемое волокно, по виду напоминающее шерсть. Лавсан обладает высокой термо-, влаго- и светостойкостью, устойчив к действию щелочей, кислот и окислителей. Из него также производят широко используемые пластиковые бутылки:
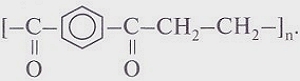
Полиамидные волокна (капрон, нейлон) по некоторым свойствам превосходят натуральный шелк. Из них вырабатывают красивые и прочные ткани и трикотаж. Капрон получают поликонденсацией ε-аминокапроновой кислоты:

Нейлон или перлон образуются при поликонденсации аминоэнантовой кислоты НООС - (СН2)4 - СООН и гексаметилендиамина NH2 - (СН2)6 - NH2. Строение цепи нейлона можно изобразить следующей химической формулой:
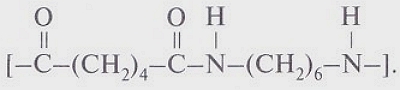
Натуральный каучук (полиизопрен) в настоящее время получают и синтетическим путем:
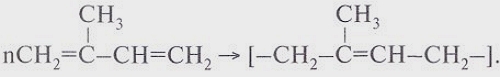
Как видно, при полимеризации обе двойные связи раскрываются, а в элементарном звене полимера появляется двойная связь на новом месте, где п колеблется от 1000 до 3000.
|
Полиацетилен - хрупкий, химически активный полимер, являющийся диэлектриком. Легко образует кристаллические производные с сильными донорами и акцепторами электронов. Например, комплекс иода с двойными связями полиацетилена является полупроводником (содержание иода ~1%), а при увеличении содержания иода до 10% он приобретает металлические свойства и парамагнитную восприимчивость. Это свидетельствует о существенной перестройке электронной структуры полимера в результате его модификации. Такой «полимерный металл» применяют в электронике и электротехнике для создания токопроводящих слоев.
Полиамидные волокна намного прочнее натурального шелка. |
Самыми важными представителями семейства полиакрилатов являются полимеры, получаемые из метиловых эфиров акриловой СН2 = СН - СООН и метакриловой СН2 = С(СНЗ) - СООН кислот:
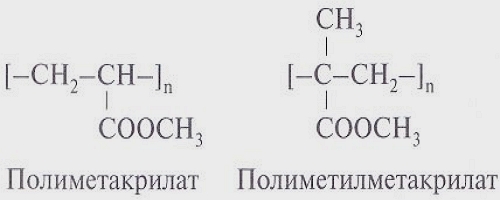
Это бесцветные, прозрачные, стойкие к нагреванию и действию света, пропускающие ультрафиолетовые лучи твердые полимеры. Из них делают органическое стекло.
Подъем промышленного производства в европейских странах в конце XVIII в. — начале XIX в. вызвал повышенный спрос на химическую продукцию и привел к возникновению крупных химических предприятий. Химическая технология начала организовываться в научную и учебную дисциплину.
|
Близ
Москвы в 1720 г. был построен первый в России химический завод по
производству азотной кислоты, купороса, красок, скипидара и
канифоли. |
СОЗДАНИЕ ТЕХНОЛОГИЧЕСКОГО ПРОИЗВОДСТВА СОДЫ Н. Лебланом в 1791 г. (Франция) оказало исключительное влияние на развитие химической промышленности. Процесс Леблана потребовал дальнейшего усовершенствования производства серной кислоты, а выделяющийся побочный продукт — хлористый водород — явился стимулом для возникновения производства соляной кислоты, ее солей, хлора и его соединений. Сегодня это мощная хлорная промышленность.
|
ЗАО «Самарский кислородный завод», компрессорный цех. |
В 1841 г. Ю. Либихом было разработано производство первого минерального удобрения (суперфосфата) на основе разложения фосфорита серной кислотой. Затем были обнаружены месторождения солей калия и начата их разработка. После открытия в начале XIX в. залежей селитры в Чили стало развиваться производство и применение азотных удобрений, азотной кислоты и взрывчатых веществ.
Добыча чилийской селитры к 1913 г. достигла 2,6 млн т.
Особенно важное значение для развития и становления химической промышленности имели следующие достижения;
• разработка контактного метода получения серной кислоты (К. Винклер);
• применение катализаторов в органическом синтезе (П. Сабатье, В. Н. Ипатьев);
• осуществлен синтез аммиака из азота и водорода (А. Ле Шателье, В. Нернст и Ф. Габер);
• создание первой установки синтеза аммиака под давлением при высокой температуре, разработка методов переработки целлюлозы в искусственные волокна (вискозные и ацетатные).
Эти исследования открыли новую эру в развитии химической промышленности и химической технологии. К середине XX в. было разработано учение об основных процессах и аппаратах химических производств, что окончательно завершило превращение химической технологии в самостоятельную научную дисциплину, способную воспринимать новейшие достижения науки.
В создание российской химической промышленности и становление химической технологии как науки огромный вклад внесли русские ученые и инженеры: М. В. Ломоносов, Д. И. Менделеев, Н. Н. Зинин, А. М. Бутлеров, В. В. Марковников, В. Н. Ипатьев, Н. Д. Зелинский, В. Г. Шухов, Н. А. Каблуков, Н. Н. Семенов и многие другие.
| Термин «химическая технология» впервые был введен в Германии в 1772 г. И. Бекманом, а затем в 1795 г. И. Гмелиным. В России первое упоминание химической технологии было сделано в 1801 г. В. М. Севергиным. | |
 |
 |
| ОАО «Нижнекамскнефтехим» - крупнейший производитель и экспортер нефтехимической продукции. | |
КЛАССИФИКАЦИЯ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ. Постоянной классификации химических производств нет до настоящего времени. Это связано с широчайшей номенклатурой химического сырья и химической продукции, разнообразными технологическими решениями и чрезвычайно большой их изменчивостью. Технологические процессы можно классифицировать по сырью, выпускаемой продукции, агрегатному состоянию реагирующих веществ, виду энергии и т. д. По сырьевому признаку химическую технологию можно подразделить на технологию переработки минерального, растительного и животного сырья, технологию угля, нефти и газа. По потребительскому признаку — на технологию удобрений, полимерных материалов, красителей, химического волокна, горюче-смазочных материалов, полупроводников и т. д. По агрегатному состоянию — на технологию жидких, газообразных и твердых систем. Чаще всего применяют классификацию по сырьевому и технологическому признакам, которые использованы и в настоящей главе.
Многообразие химических процессов обусловливает разнообразие конструкций аппаратов, в которых осуществляются эти процессы.
Любой химико-технологический процесс включает в себя три основные стадии: подготовка сырья, его химическая переработка, очистка и выделение готового продукта. Выбор операций на каждой стадии химико-технологического процесса во многом определяется агрегатным состоянием веществ.
|
Дробление - измельчение твердых веществ механическим воздействием -проводят в молотковых или щековых дробилках.
Тонкое измельчение осуществляют в мельницах различной
конструкции -валковых, шаровых и вибрационных.
Щековая дробилка для крупного измельчения. |
Первая стадия. Твердое сырье необходимо подвергнуть измельчению, удалить из него примеси (например, пустую породу), в ряде случаев требуется удаление влаги и другие операции. Измельчение производят с помощью дробилок и мельниц, для удаления примесей используют классификаторы, сита, сепараторы и флотационные машины, влаги — сушильные агрегаты. Кроме того, необходимы транспортеры, трубопроводы, мерники, насосы и другая аппаратура.
Для очистки жидкого сырья применяют методы ректификации, дегазации (удаление газообразных продуктов), нагревания в вакууме, экстракции примесей соответствующими растворителями. Их осуществляют с применением ректификационных колонн, теплообменников, абсорберов, аппаратов для подогрева жидкостей и вакуумирования. При этом используют различные типы насосов и емкостей для очищенного сырья и отделяемых примесей.
Вторая стадия является ключевой (основной) стадией любого химического производства. Подготовленное сырье и другие компоненты подвергаются разнообразным химическим превращениям. В результате химических взаимодействий одновременно образуются разные соединения — от промежуточных до конечных и побочных продуктов реакции. Направленность химических процессов во многом определяется правильным выбором реакционного аппарата — реактора. Современный химический реактор — это сложный аппарат. Он обеспечивает реализацию различных тепловых режимов и поддержание необходимого давления и разрежения, создание разнообразных способов перемешивания, подачу в реактор твердых, жидких и газообразных веществ и т. д., т. е. поддержание необходимого технологического режима. Реакторы обычно приспосабливают к конкретным технологическим процессам.
Третья стадия. Когда химический процесс завершен, продукты из реактора направляются на дальнейшую переработку, целью которой является выделение готового продукта и очистка его от примесей. Последние состоят из частично не прореагировавшего исходного вещества и примесей, которые находились в нем или образовались в результате побочных химических реакций.
Выделение твердых продуктов чаще всего осуществляют фильтрованием или центрифугированием с отмывкой растворителями примесей и последующей сушкой продукта. Жидкие продукты разделяют ректификацией. Нередко для получения высокочистого продукта процесс ректификации проводят несколько раз.
Разделение газов основано либо на ректификации газовой смеси, либо на методах сорбции на жидких или твердых сорбентах. В последнее время широкое распространение получила мембранная технология разделения или очистки химических продуктов.
 |
 |
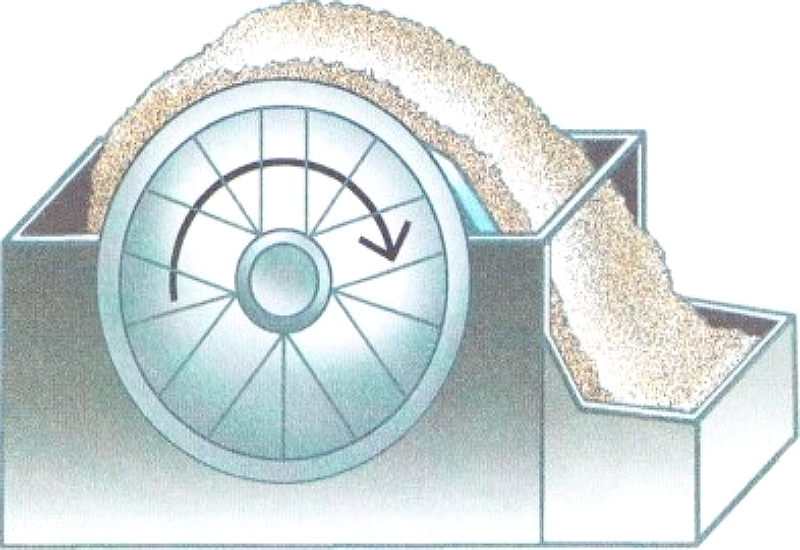 |
| Абсорбер для очистки газов. | Химический реактор с мешалкой. | Барабанный вакуумный фильтр. |
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС - это сложная система, состоящая из множества связанных между собой процессов и взаимодействующая с окружающей средой. Элементами химико-технологической системы являются процессы тепло- и массообмена, гидромеханические, химические, диффузионные и др. На основе анализа единичных процессов разрабатывается технологический режим процесса в целом.
Основой для разработки технологического процесса служит материальный и энергетический баланс. На базе материального и энергетического баланса осуществляют экономическую оценку производства.
|
Таблица материального баланса состоит из двух частей:
приходной - для введенных веществ, и расходной - для полученных
веществ и потерь. В таблицах материального баланса статьи прихода и
расхода выражаются не только в массовых или объемных единицах, но и
в процентах, что более наглядно отражает степень использования
сырья, выход целевого продукта и побочных продуктов, а также потери.
Данные материального баланса используются для расчета
энергетического баланса, габаритов основного реактора и всей
необходимой аппаратуры технологического процесса, себестоимости
продукта. Баланс отражает условия эксплуатации и степень
совершенства процесса.
|
МАТЕРИАЛЬНЫЙ БАЛАНС основывается на законе сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции, т. е. приход вещества Вприх равен его расходу Врасх. Уравнение материального баланса выглядит так:
Вприх = Врасх.
Материальный баланс составляют по уравнению основной суммарной реакции (с учетом протекания важнейших побочных реакций) для процесса в целом или для отдельных его стадий. Он может быть выражен в виде уравнений, таблиц или диаграмм. Учет массы веществ производят отдельно для исходных (приход) и полученных (расход) веществ и для потерь, отдельно для твердой, жидкой и газовой фаз. По материальному балансу рассчитывают расходные коэффициенты — количество исходного сырья, которое приходится на единицу готового продукта, — обычно на 1 т.
При составлении материального баланса необходимо знать химический состав, а также физические и физико-химические свойства исходного сырья, полупродуктов и конечных продуктов.
В ОСНОВУ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА положен закон сохранения энергии, согласно которому количество энергии, введенной в данной процесс, равно количеству выделяющейся энергии, т. е. приход энергии равен ее расходу:
Qприх = Qpacx.
Энергетический баланс рассчитывается аналогично материальному балансу, с учетом всех тепловых потоков химических реакций и физических превращений, происходящих в аппаратах, с учетом подвода или отвода тепла.
| Необходимость в АСУ ТП наглядно видна на примере производства аммиака, где задействовано порядка десяти реакторов, заполненных катализаторами, имеется много подогревателей, теплообменников, сепараторов и другого оборудования. Через всю систему проходит газовая смесь при разной температуре и давлении с объемной скоростью 25000 м3/ч. В каждом технологическом узле должны поддерживаться определенные концентрация продуктов, температура и давление, контролироваться работа катализаторов. Производительность колонны синтеза аммиака составляет 1360 т в сутки, или 450000 т в год. | |
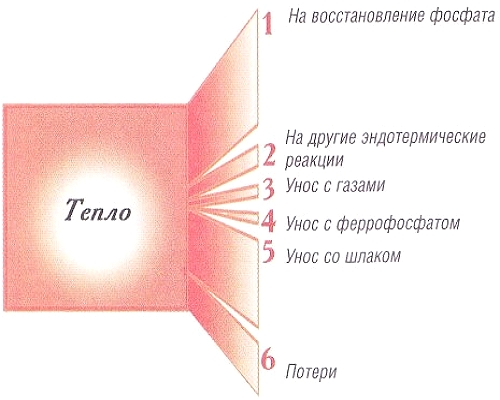 |
 |
| Диаграмма энергетического баланса производства фосфора (на 1 т). | Колонна синтеза аммиака. |
УПРАВЛЕНИЕ ТЕХНОЛОГИЧЕСКИМ ПРОЦЕССОМ. Среди автоматизированных систем информационные системы по химии занимают особое место, что связано с необходимостью переработки больших объемов информации о ведении химико-технологических процессов, сложностью и трудоемкостью самих процессов.
Современное химическое производство является высокоавтоматизированным. Управление химико-технологическим производством осуществляется на трех уровнях:
1) стабилизация всех потоков в каждом аппарате на начальной стадии производства;
2) координация отдельных процессов, протекающих на всех участках технологической цепочки, с использованием автоматизированной системы управления технологическим процессом (АСУ ТП);
3) координация и управление всеми производствами предприятия, осуществляемые с помощью автоматизированной системы управления предприятием (АСУП).
АСУП позволяет определять и планировать запасы сырья и реагентов, распределять их по отдельным производственным участкам; организовывать распределение готовых продуктов, проводить анализ экономической эффективности отдельных производств и предприятия в целом и т. д.
Химическая промышленность, научной базой которой является химическая технология, объединяет целый комплекс различных отраслей производства, ис-пользующих химические методы переработки сырья и материалов. Ежегодно химическая промышленность производит десятки тысяч наименований продуктов и полуфабрикатов.
|
Современные химические предприятия производят различную продукцию, используя для этого не только сырье, но и побочные продукты, а также отходы производства. Так, заводы, выпускающие NH3, производят кроме HNO3, мочевины и солей аммония также и капролактам - исходное сырье для получения капрона. Из синтез-газа, который применяется в производстве NH3, получают и метиловый спирт. При окислительном пиролизе метана кроме синтез-газа образуется ацетилен, из него взаимодействием с НСL получают винилхлорид.
ЗАО «Куйбышевазот» |
ПО СЫРЬЕВЫМ И ПОТРЕБИТЕЛЬСКИМ СВОЙСТВАМ химическую промышленность разделяют на ряд отраслей.
Основная химия — производство неорганических кислот: серной, азотной и фосфорной, солей, щелочей и удобрений.
Основной органический синтез — производство карбоновых кислот: уксусной, адипиновой, синтетических жирных кислот; спиртов: метилового, этилового, пропилового, бутилового, и высших спиртов; сложных эфиров, аминов и др.
Нефтехимия — производство топлива: бензинов, керосина, дизельного топлива, реактивного топлива; минеральных масел и мазута; ароматических углеводородов: бензола, толуола, ксилолов; непредельных углеводородов: этилена, пропилена, бутилена, бутадиена, изопрена, хлоропрена, стирола, винилхлорида и др.
Углехимия — производство кокса, полукокса, жидких углеводородов; переработка коксохимической смолы и газов; получение ароматических углеводородов: бензола, ксилолов, фенолов, нафталина, пиридинов; непредельных соединений — этилена, пропилена; водорода, метана и др.
Производство полимерных материалов: пластмасс — полиэтилена, полипропилена, полистирола, поливинилхлорида, фенолформальдегидных и мочевино-альдегидных смол; химических волокон — полиамидных (капрона, нейлона, фенилона), полиэфирных (лавсана), полиакрилонитрильных (нитрона), синтетических волокон (ацетатное, вискозное).
Производство синтетических каучуков — бутадиенового, изопренового, бутадиенстирольного, хлоропренового, полиуретанового.
Производство резинотехнических изделий — покрышки, транспортные ленты, рукава, шланги, уплотнители, прокладки и др.
Электрохимия — производство щелочей, хлора, водорода, кислорода; цветных и щелочных металлов (алюминий, медь, титан, натрий, калий и др.).
Тонкий органический синтез — производство фармацевтических препаратов, реактивов, ингибиторов коррозии металлов, инсектицидов (средств для борьбы с вредителями сельского хозяйства).
Лакокрасочная промышленность — производство минеральных и органических пигментов и красок на их основе, эмалей, лаков и других лакокрасочных материалов; разбавителей, сиккативов, специальных растворителей для красок и лаков.
| В последнее десятилетие XX в. получила развитие сверхкритическая флюидная технология, позволяющая многие процессы проводить в более легких условиях по температурам и давлениям, с высокой скоростью, меньшими энергетическими затратами и значительным снижением количества отходов. В сверхкритических флюидах резко увеличивается растворимость многих веществ, и процессы можно проводить в гомогенной фазе. Так, в воде, находящейся в сверхкритическом состоянии, растворимость водорода и кислорода достигает 30 - 40%, и процессы гидрирования и окисления многих органических соединений протекают с большой скоростью. | |
 |
 |
| Цех завода тонкого органического синтеза в Долгопрудном. | |
К многотоннажным (выпускающим продукцию десятками миллионов тонн в год) можно отнести следующие производства: кислот (серная, азотная, фосфорная), минеральных удобрений (азотных, фосфорных, калийных), спиртов (метилового и этилового), автомобильного и дизельного топлива, минеральных масел, непредельных углеводородов (этилена, пропилена, винилхлорида).
Технический прогресс в последней четверти XX в. внес существенные изменения в технологию многотоннажных неорганических и органических продуктов. Это проявилось в усовершенствовании существующих и внедрении новых технологических процессов с использованием альтернативных видов сырья, высокопроизводительной аппаратуры и эффективных катализаторов.
Быстрыми темпами развивается промышленность полимерных материалов, что связано с широким использованием в качестве сырья продуктов переработки нефти и газа.
Значительное развитие получила промышленность малотоннажных химических продуктов — производство химических реактивов и особо чистых веществ, полупроводниковых материалов, химикофармацевтических препаратов, химикофотографических материалов, товаров бытовой химии (моющие порошки, средства ухода за бытовой техникой и сантехническим оборудованием и т. д.).
В природе азот связывается в оксиды при грозовых разрядах. Источником пополнения азотных соединений почвы является деятельность азотобактерий, способных усваивать азот из воздуха. Таким образом, в природе совершается непрерывный круговорот азота. Однако этих источников не хватает для покрытия убыли азота из почвы.
|
в сельском хозяйстве для повышения урожайности культур применяются удобрения - азотные, фосфорные, калийные и др. Предпочтение отдают высококонцентрированным удобрениям, к которым относятся жидкий NH3 и мочевина. Содержание связанного азота в них составляет 82,3 и 46,6% соответственно. В ряде стран NНз применяют в качестве удобрения непосредственным введением его в почву в виде безводного аммиака или водных растворов. Для этого используют специальные агрегаты, которые, подрезая слой почвы, вносят удобрение в определенных дозах. Жидкий NH3 можно хранить или под давлением 20 атм, или при температуре ~33° С, так как он имеет высокую упругость пара и легко испаряется. Но если растворить в жидком NН3 мочевину, упругость пара насыщенного раствора резко снизится. Такой раствор высококонцентрированного удобрения можно транспортировать по трубопроводам на значительные расстояния. |
Большая часть азота (78,09% по объему) находится в природе в свободном состоянии в виде молекулы N2, состоящей из двух атомов, связанных между собой тройной связью N ≡ N. Энергия связи в молекуле азота очень велика и составляет 941,6 кДж/моль, поэтому N2 химически инертен. В начале XX в. были открыты три способа фиксации азота воздуха — дуговой, цианамидный и аммиачный.
Дуговой. При пропускании воздуха через электрическую дугу при температуре 3000° С кислород окисляет азот до оксида:
N2 + О2 = 2NO.
Выход NO составляет всего 2 - 3%. Газовую смесь охлаждают, NO окисляют кислородом воздуха до NO2, который превращают в азотную кислоту:
3NO2 + Н2О = 2HNO3 + NO.
Цианамидный. Метод основан на способности азота при высокой температуре (1000° С) взаимодействовать с карбидом кальция СаС2, образуя цианамид кальция CaCN2:
СаС2 + N2 = CaCN2 + С.
При действии на CaCN2 водяного пара под давлением 0,6 МПа он легко разлагается с образованием аммиака и карбоната кальция:
CaCN2 + ЗН2О = СаСОз + 2NH3.
Аммиачный. Этот метод является основным способом связывания атмосферного азота и базируется на реакции взаимодействия азота с водородом с образованием аммиака. Важнейшими продуктами, получаемыми в результате фиксации азота, являются аммиак NH3 и азотная кислота HNO3.
ПРОИЗВОДСТВО АММИАКА. Реакция образования аммиака N2 + ЗН2 = 2NH3 + Q протекает в очень жестких условиях: температура 400 - 500° С, давление 30 - 35 МПа. В качестве катализатора используют железо с добавками, повышающими его активность, термическую стабильность и механическую прочность. Реакция обратима, сопровождается выделением тепла и уменьшением объема смеси в 2 раза. Поэтому понижение температуры и повышение давления смещают равновесие реакции в сторону образования аммиака. Найти оптимальные условия проведения процесса удалось только с открытием термодинамических закономерностей. Технологическая схема процесса представлена на рисунке. Исходное сырье — азотоводородную смесь — получают непрерывной паровоздушной конверсией природного газа — метана — на различных катализаторах. Эта стадия:
СН4 + Н2О + 1/2О2(N2) → N2 + ЗН2 + СО2 — самая энергоемкая (80% всех энергетических расходов).
После удаления паров воды, О2, оксидов С и S, отравляющих катализатор, смесь поступает в колонну синтеза NH3. Это полочный реактор высотой 32 м и диаметром 2500 мм. Толщина стенок составляет 250 мм. На четырех полках реактора находится 120 т катализатора. В колонне имеется внутренний теплообменник, регулирующий тепловые потоки. Колонна работает в интервале температур 400 - 515° С под давлением 30 - 35 МПа. Производительность колонны составляет 1360 т аммиака в сутки. Выход NH3 при однократном прохождении газовой смеси через колонну достигает 15 - 17%. Поэтому после удаления образовавшегося NH3 сжижением газовую смесь вновь возвращают в колонну. Синтез NH3 относится к опасным и сложным в управлении производствам. Тем не менее вот уже более 90 лет аммиак получают по способу Габера — Боша.
|
Наиболее эффективный способ получения аммиака был разработан немецким химиком Ф. Габером. На лабораторной установке Ф. Габер осуществил взаимодействие водорода с азотом с образованием аммиака. Реакция проходила в присутствии Мп-катализатора при высоком давлении и температуре. Однако Ф. Габер не сумел решить ряд технических вопросов. В частности, ему не удалось подобрать материал реактора, который не пропускал бы водород при высокой температуре и давлении. Эти технические проблемы были успешно разрешены инженером К. Бошем. А в 1913 г. Ф. Габер и К. Бош создали промышленную установку синтеза аммиака на Баденской анилиносодовой фабрике. Схема промышленной установки синтеза аммиака показана на рисунке.
Запуск американского космического челнока «Шаттл». |
ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ осуществляется путем каталитического окисления аммиака с последующим поглощением диоксида азота водой. В начале XX в. были разработаны методы окисления NH3 кислородом на платине.
В настоящее время основным способом производства HNO3 является окисление аммиака кислородом воздуха при 800 - 850° С и давлении 0,76 - 1,10 МПа в присутствии катализатора — металлической платины или ее сплавов — платины с родием (N1) и платины с родием и палладием (N5), изготовленного в виде сетки из проволоки диаметром 0,06 - 0,09 мм.
Производство азотной кислоты — многостадийный процесс. Сначала при окислении аммиака образуется оксид азота:
4NH3 + 5О2 = 4NO + 6Н2О,
далее оксид азота окисляется до диоксида:
2NO + О2 = 2NO2,
и, наконец, NO2 поглощается водой с образованием HNO3:
3NO2 + Н2О = 2HNO3 + NO.
Выделившийся NO снова окисляют до NO2.
В зависимости от давления в процессе поглощения нитрозных газов водой может образовываться азотная кислота с концентрацией от 48 до 65%.
|
В процессе окисления аммиака происходит частичная потеря платины в количестве 0,05 - 0,30 г на 1 т HNO3. Это довольно значительные потери, так как современные схемы производства рассчитаны на получение 450 тыс. т кислоты в год.
Технологическая схема процесса производства аммиака: |
Концентрированную азотную кислоту получают при перегонке разбавленной кислоты (50 - 60%) в присутствии концентрированной H2SO4 или Mg(NО3)2.
Есть и прямой способ получения 98%-ной HNO3 на основе жидкого 100%-ного NО2 при 75° С и 5 МПа в присутствии кислорода и воды.
ПРОИЗВОДСТВО АЗОТНОКИСЛОГО АММОНИЯ NH4NO3 основано на простой химической реакции:
NH3 + HNO3 = NH4NO3 + Q,
NH4NO3 получают практически безводным (99,98%). В процессе реакции выделяется большое количество теплоты, которую надо быстро отводить и использовать, так как при температуре 300° С NH4NO3 может взорваться. В нижнюю часть реактора по одному каналу подают нагретую до 80° С 60%-ную HNO3, а по другому — газообразный NH3, подогретый до 120° С. Исходные продукты нагреваются водяным паром, образующимся при испарении воды, содержащейся в 60%-ной HNO3. В процессе производства азотнокислого аммония температура в реакторе поднимается до 170° С, а концентрация раствора достигает 92%. Полученный раствор NH4NO3 после упаривают в пленочном испарителе до концентрации 99,8% и направляют в грануляционную башню высотой 55 м. Расплав NH4NO3, подаваемый в верхнюю часть башни, разбрызгивается, капли, охлаждаясь встречным потоком воздуха, затвердевают.
|
Промышленная установка по производству аммиачной селитры. |
Для снижения гигроскопичности в расплав NH4NO3 перед грануляцией вводят некоторые соли — (NH4)2SО4, Mg(NО3)2 и др.
ПРОИЗВОДСТВО МОЧЕВИНЫ. Мочевину получают взаимодействием аммиака с диоксидом углерода при 150 - 190° С и давлении 15 - 20 МПа:
2NH3 + СО2 = H2NCONH2 + Н2О.
Сырьем в производстве мочевины служат аммиак и СО2, последний является побочным продуктом в производстве аммиака. Процесс протекает в избытке аммиака. Водный раствор мочевины упаривают до концентрации 98 - 99%.
|
Аммиачная селитра содержит 35% азота, причем одна половина азота находится в нитратной форме (NО3-), а другая - в аммиачной (NH4+). Нитратный азот усваивается растениями в почве быстрее, он эффективен в период роста растений, аммиачный же. напротив, действует медленнее. Растения усваивают из почвы весь азот, поэтому азотнокислый аммоний является одним из ценных и экологически чистых удобрений.
|
Полученный продукт подвергается гранулированию из
расплава в специальных башнях. В расплав перед грануляцией вводят некоторые
добавки для снижения гигроскопичности, являющейся причиной слеживаемости
продукта при хранении. Технология мочевины — один из образцов комплексного
использования сырья и побочных продуктов.
Топливо — это горючее ископаемое вещество, основной составляющей которого является углерод. К природным источникам топлива относится каменный уголь, нефть, природный газ, горючие сланцы, торф, древесина и растительные отходы.
|
Еще за 5 - 6 тыс. лет до н. э. были известны битумы и
асфальты, образовавшиеся при длительном окислении нефти, выходящей
на поверхность земли. Они применялись в качестве связующего
материала при строительстве, для пропитки древесины или камыша,
бальзамирования мумий и т. д. При строительстве Великой Китайской
стены был использован битум. В знаменитых висячих садах Семирамиды в
Ассирии (одно из семи чудес света) подвешенные на столбах чаши для
деревьев были изготовлены из смеси камней с асфальтом.
|
НЕФТЬ И ЕЕ ПЕРЕРАБОТКА. Нефть представляет собой сложную смесь органических веществ — более 1000 различных индивидуальных углеводородов и соединений с кислородом, серой и азотом. Низкомолекулярные газообразные углеводороды (от метана до бутана), входящие в состав нефти, образуют и отдельные крупные месторождения природного газа, запасы которого составляют 200 трлн м3. Природный газ используется в качестве топлива. Из него получают большое количество тех же продуктов, что и из нефти. Нефть имеет следующий элементный состав, %: углерод — 84 - 87, водород — 12 - 14, кислород, азот и сера — 1 - 2. Кислородные соединения — это нафтеновые кислоты и асфальтены; соединения азота — пиридины, хинолины, амины; соединения серы — сульфиды, меркаптаны, тиофены. В нефти встречаются и некоторые металлы: V — 0,01%, Ni — 0,003%, а также Fe, Ca, Mg, Al, Ti и др. Среди углеводородов в нефти больше всего алкановых (от 30 до 50%), остальные углеводороды — нафтеновые (более 25%), ароматические (10 - 20%, иногда до 35%) и др.
Способы переработки нефти определяются ее составом. Сначала отделяют газообразные продукты (попутные газы), из которых выделяют этан, пропан и бутан, далее при нагревании удаляют легкокипящие фракции (бензины). Затем следует промывка водой с разделением нефти и воды в отстойниках. Эмульсионную воду из нефти удаляют электрообезвоживанием — пропусканием тонкого слоя нефти через электроды при 80° С с напряжением переменного тока 30 - 45 кВ. После такой обработки в нефти остается 0,2% воды и не более 3 мг/л солей.
|
Со времени открытия первых месторождений нефти минуло
более 150 лет. Большие запасы нефти сосредоточены в России,
Казахстане, Азербайджане, странах Азии (Саудовская Аравия, Ирак,
Кувейт, Иран, Объединенные Арабские Эмираты, Индонезия, Китай),
Америке (Венесуэла, США, Мексика). Крупных месторождений нефти,
исчисляемых миллиардами тонн, немного - всего 5% от общего числа.
Они дают около 85% всей добываемой в мире нефти.
Основные фракции при перегонке нефти. |
Очищенная нефть подвергается прямой перегонке (схема процесса показана на рисунке). Для этого ее нагревают в трубчатых печах до 350° С и направляют в ректификационную колонну, где происходит разделение на отдельные фракции в зависимости от температуры кипения компонентов. Остаток после перегонки — мазут (до 55%) — нагревают в трубчатой печи до 420° С и подвергают перегонке в вакууме. Таким способом получают масла — веретенное, машинное, цилиндровое и др. Остатком после перегонки является гудрон.
Полученные при первичной переработке нефти продукты далее подвергают вторичной переработке — крекингу, при котором происходит разрыв С - С-связей при высоких температуре и давлении в присутствии катализаторов. В результате получают высококачественное топливо — бензин, реактивное и дизельное топливо, а также индивидуальные углеводороды — ароматические, непредельные, циклические и т. д.
Вторичной переработкой мазута и гудрона при 500° С дополнительно получают бензин, непредельные углеводороды и нефтяной кокс.
Таким образом, при переработке нефти нет отходов — все выделяемые продукты находят применение. Ежегодно перерабатывается 3 млрд т нефти и млрд м3 газа.
ИСКОПАЕМЫЙ КАМЕННЫЙ УГОЛЬ - твердое горючее растительного происхождения. Он используется как непосредственно для сжигания, так и для переработки в более ценные виды топлива — кокс, жидкое горючее, газообразное топливо.
Чем старше уголь, тем больше в нем содержится углерода. Различают три вида угля: антрацит — самый древний (95% С), бурый уголь (65 - 70% С) и наиболее известный каменный уголь (75 - 90% С). Кроме углерода в каменном угле содержится: 1,5 - 5,7% водорода (что значительно меньше, чем в нефти), 1,5 - 15% кислорода, 0,5 - 4% серы, до 1,5% азота, 12 - 45% летучих вещств, влаги — от 4 до 14% (иногда до 30 - 40%), золы — от 2 до 45%. Главными составляющими золы являются оксиды Аl, Si, Fe, редкие и рассеянные элементы Ga, V, W, Ti и др., а также Аu и Аg. Плотность углей колеблется в пределах от 1,16 до 1,47 г/cм3 теплота сгорания — от 17,3 до 32 МДж/кг.
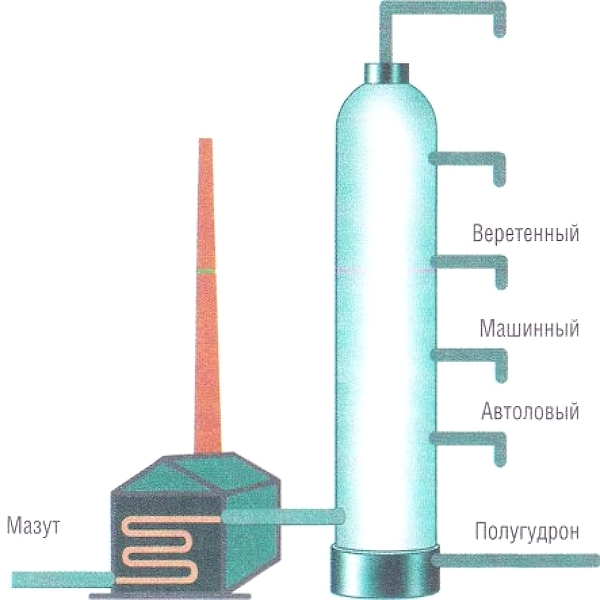 |
 |
| Схема производства минеральных масел из нефти. | Добыча угля открытым способом. Угольный карьер. |
Запасы каменного угля в нашей стране составляют 40% от мировых. Большое количество угля перерабатывается в кокс, идущий на выплавку чугуна. В XXI в. при переходе на восстановление железных руд оксидом углерода или природным газом (что уже осуществляется у нас на Оскольском электрометаллургическом комбинате) необходимость в производстве кокса отпадет. Уголь будет перерабатываться в ценное жидкое и газообразное углеводородное сырье.
Для переработки угля применяются различные методы: пиролиз (процессы полукоксования и коксования), газификация и гидрогенизация.
ПОЛУКОКСОВАНИЕ НИЗКОСОРТНЫХ углей и бурого угля осуществляется при температуре 500 - 580° С без доступа воздуха в печах с внешним обогревом. Продуктами полукоксования являются полукокс, смолы и газ. Полукокс (55 - 74% от исходного продукта) потребляется как местное топливо. Газ, обладая высокой теплотой сгорания, является ценным энергетическим топливом и сырьем для химической промышленности. Он имеет следующий состав, %: этилен — 8, оксид углерода — 11,5, водород — 19, предельные углеводороды — 15 - 50, азот — 5. Производительность процесса по газу достигает до 165 м3/т. Смола содержит ценные органические соединения — непредельные углеводороды, кислоты, фенолы, пиридиновые основания и масла.
КОКСОВАНИЕ - наиболее распространенный метод переработки каменного угля. Он осуществляется в коксовых печах при температуре 900 - 1050° С без доступа воздуха. Продуктами коксования являются твердый остаток — кокс — и коксовый газ.
Для коксования используют угли, способные при 350 - 400° С переходить в пластичное состояние и образующие прочный кокс. Кокс применяется как восстановитель при выплавке чугуна. Состав продуктов коксования, %: кокс — 65 - 80; смолы — 3 - 5; сырой бензол — 1 - 1,1; сульфат аммония — 1,2 и коксовый газ — 15 - 18 (340 м3 на 1 т).
|
Разработан метод пиролиза высокосернистых углей в
присутствии катализаторов - расплавов солей щелочных металлов. В
качестве основного продукта в этом процессе образуется этилен с
выходом 30 - 60%. Это один из перспективных методов получения
этилена из угля низкого качества. Газификации может подвергаться
любое твердое топливо - торф, низкосортный уголь, сланцы, отходы
древесины.
|
ГАЗИФИКАЦИЯ — это процесс обработки нагретого до 1000° С угля смесью воздуха и водяного пара. В результате образуется генераторный газ, состоящий в основном из монооксида углерода, водорода, небольшого количества СО2 (~4%) и азота. Если при газификации используют смесь кислорода и водяного пара, то получается более концентрированный газ, содержащий 66% СО и 31% Н2. Генераторный газ применяют в качестве топлива (теплота его сгорания порядка 10000 кДж/м3), кроме того, он является ценным сырьем в технологии органического синтеза.
ГИДРОГЕНИЗАЦИЯ. Процесс прямого получения искусственного жидкого
топлива из каменного угля. Метод основан на гидрировании органической части
углей водородом под высоким давлением 20 - 70 МПа при температуре 380 - 550° С
(катализаторы, содержащие сульфиды Мо, соединения Fе,
Сг и других элементов). При гидрогенизации образуется широкая фракция
среднего масла, которую после удаления фенолов вновь подвергают гидрированию в
паровой фазе при 400 - 500° С и давлении 30 - 60 МПа, с катализатором. Конечные
продукты процесса — бензин и энергетический газ, содержащий легкие углеводороды.
Промышленность органического синтеза в настоящее время производит более 300 тыс. наименований органических соединений.
СУЩЕСТВУЕТ ПЯТЬ ГЛАВНЫХ ГРУПП исходных веществ для синтеза основной массы органических соединений: алканы — от метана СН4 до углеводородов С40: алкены — этилен, пропилен, бутилен, изопрен и др.; ароматические углеводороды — бензол, толуол, ксилолы, нафталин; оксид углерода и синтез-газ (СО и Н2); ацетилен.
|
Схема процесса пиролиза углеводородов:
4 - сепаратор; |
ПЕРЕРАБОТКУ АЛКАНОВ производят с применением следующих основных методов: дегидрирование, пиролиз, конверсия, изомеризация, ароматизация, окисление и др.
ДЕГИДРИРОВАНИЕ — это процесс превращения предельных углеводородов в непредельные. Отщепление водорода происходит при температуре выше 650 - 850° С. В качестве катализаторов используют многокомпонентные системы из переходных металлов или их оксидов. Процессу дегидрирования подвергают алканы — от этана до бутана. Основными продуктами являются этилен и пропилен. Процесс характеризуется образованием большого количества побочных продуктов. Алкены разделяют низкотемпературной ректификацией или экстракцией.
ПИРОЛИЗ — термическое разложение углеводородов (в основном бензиновых и лигроиновых фракций) первичной переработки нефти. Это высокотемпературный процесс. Он протекает при 750 - 850° С и атмосферном давлении. Для снижения коксообразования в газовую смесь вводят перегретый пар. Продукты пиролиза быстро охлаждают водой, ароматические углеводороды экстрагируют маслом. Газообразные продукты разделяют низкотемпературной ректификацией или экстракцией. В газах пиролиза содержится 30 - 40% этилена, 20 - 27% пропилена, 9% бутиленов и бутадиена. Остальное составляет смола пиролиза, которая включает в себя ароматические и циклические углеводороды и высшие (С5 и выше) алкены.
 |
 |
|
Фрагмент трубчатого теплообменника. |
Схема
процесса конверсии углеводородов: |
КОНВЕРСИЯ является одним из важнейших процессов переработки алканов. Она основана на их окислении кислородом воздуха, водяным паром или диоксидом углерода:
2СН4 + О2 = 2СО + 4Н2 + Q;
СН4 + Н2О = СО + ЗН2 + Q;
СН4 + СО2 = 2СО + 2Н2 + Q.
Конверсии подвергаются природный газ, а также жидкие и твердые углеводороды (схема процесса представлена на рисунке. Основным продуктом конверсии является синтез-газ (смесь СО + Н2) — важнейшее сырье для производства большого числа ценных продуктов. Процесс проводят при 850° С и небольшом давлении (2,3 МПа) в присутствии катализатора (Ni на оксидах Аl, Мg и Сг), с использованием в качестве окислителя водяного пара или диоксида углерода. В отсутствие катализатора конверсия протекает при 1350 - 1450° С:
СН4 + О2 = СО + Н2 + Н2О.
При этом образуется 7% ацетилена.
|
в нашей
стране разработан новый процесс производства высокооктановых
бензинов из различных фракций нефти, выкипающих до 200 - 250° С.
Этот процесс называется цеоформингом. Он основан на применении
нового цеолитсодержащего катализатора ИК-30 и проводится при
температуре 400 - 460° С и давлении 1МПа. В зависимости от выбранных
условий получаются бензины с 04 80, 91, 93 и 95, с выходом от 63 до
84%. В этом процессе не требуется предварительной очистки сырья от
серы. В целевом продукте содержится 0,03 - 0,05% серы. Так
производится неэтилированный бензин любой марки - от АИ-80 до АИ-95. |
ИЗОМЕРИЗАЦИЮ И АРОМАТИЗАЦИЮ АЛКАНОВ осуществляют при 470 - 540° С с использованием Pt и Re-катализаторов, нанесенных на Al2O3 (процесс платформинга). При давлении 2 - 3 МПа образуются ароматические углеводороды (бензол, толуол и ксилолы), а при давлении 5 МПа происходит изомеризация алканов линейного строения в разветвленные углеводороды. Изомеризации подвергают прямогонные бензины с 04 55 - 65. В результате получают бензин с 04 95. В последнее время разработан эффективный вариант окислительной конденсации метана, перспективный для получения этилена. Процесс проводят при температуре свыше 700° С и атмосферном давлении в присутствии различных кататшзаторов: оксидов Мg, Са и Sr, редкоземельных элементов, а также Мn, Ni, РЬ и др. Дегидродимеризацией метана в присутствии хлора при температуре 1000° С и давлении 1,2 МПа получают этилен. При этом образуются бензол, ацетилен и хлористый водород. Из ацетилена и НСl производят хлорвинил. В этом процессе нет отходов.
Мировое производство ароматических углеводородов превышает 45 млн т в год, высокооктанового топлива — десятки миллионов тонн в год.
|
Производство оксида этилена. |
ПЕРЕРАБОТКА АЛКЕНОВ. Алкены имеют высокую реакционную способность, они легко вступают в различные реакции присоединения по двойной связи с образованием спиртов, кислот, оксисоединений, галоидных углеводородов. Они легко полимеризируются. Гидратацией низших алкенов производят этиловый (этанол), пропиловый и бутиловый спирты, объем их выпуска исчисляется многими миллионами тонн. Из высших алкенов (С10 - С20) образуются спирты, которые перерабатывают далее в моющие средства.
ПОЛУ4ЕНИЕ ЭТАНОЛА. В течение длительного времени этанол получали из пищевого сырья (картофель, рожь, кукуруза, свекла, виноград) сбраживанием крахмала и ферментативным окислением сахаров. В начале XX в. был разработан метод гидролиза отходов древесины и сбраживания образующегося раствора глюкозы до спирта.
ПРОИЗВОДСТВО СИНТЕТИЧЕСКОГО этилового СПИРТА. При действии концентрированной серной кислоты на этилен при 70° С образуется диэтилсульфат, который гидролизуют водой до спирта:
2СН2 = СН2 + H2SO4 = (C2H5О)2SО2;
(C2H5О5)2SО2 + 2Н2О = 2С2Н5ОН + H2SO4.
Полученную при этом 50%-ную H2SO4 концентрируют отгонкой воды. Прямая гидратация этилена водяным паром проводится в более жестких условиях — при температуре 280 - 300° С, давлении 6 - 8 МПа и в присутствии катализатора — 85%-ной фосфорной кислоты, нанесенной на алюмосиликат.
В этом процессе наряду с этанолом образуются другие спирты и уксусный альдегид. При ректификации отделить высокотоксичный уксусный альдегид невозможно, поэтому спиртовую фракцию приходится гидрировать водородом и снова проводить ректификацию, что значительно усложняет процесс.
Биотехнологический способ получения этанола см. ниже, в разделе «Биотехнология».
|
Производство паратретичного бутилфенола. |
РЕАКЦИЯ ОКИСЛЕНИЯ АЛКЕНОВ кислородом воздуха, в зависимости от условий ее проведения, приводит к образованию серии разнообразных продуктов, являющихся ценным сырьем для проведения многих видов синтеза. При окислении этилена в присутствии серебряного катализатора при температуре 220 - 280° С и давлении 0,5 - 2,5 МПа образуется оксид этилена;
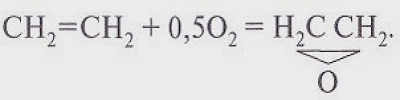
|
Продукты, получаемые переработкой алканов. |
|
Продукты, получаемые переработкой алкенов. |
Если же окисление этилена проводить на другом катализаторе — хлориде палладия PdCl2 — в присутствии раствора солей меди, температуре 110 - 130° С и давлении 1,1 МПа, то получится уксусный альдегид:
СН2 = СН2 + 0,5О2 = СН3СНО,
из которого производят спирт, уксусную кислоту, ее эфиры и другие соединения. Проведение процесса в растворе уксусной кислоты в аналогичных условиях приводит к получению винилацетата — сырья в синтезе полимеров:
СН2 = СН2 + СН3СООН + 0,5О2 = СН2 = СН - ОСОСН3 + H2O.
ХЛОРИРОВАНИЕ АЛКЕНОВ. При невысокой температуре под действием галогенов алкены превращают в дигалоидные соединения, из которых получают полимерные материалы, растворители жиров, хладагенты (фреоны), химикаты для борьбы с вредителями и т. д.
|
Конденсацией изобутилена с метиловым спиртом при температуре 50 - 70° С и давлении 1 МПа в присутствии H2SO4 или катионита КУ-2 образуется метилтретбутиловый эфир (МТБЭ) СН3О - С(СН3)3. Он имеет октановое число 118, и его применяют в качестве добавки (7 - 15%) для увеличения октанового числа бензинов вместо тетраэтилсвинца. Ежегодный выпуск МТБЭ составляет 25 млн т. |
Этилен хлорируют в растворе дихлорэтана при температуре 70° С без катализатора или в присутствии FеСl3:
СН2 = СН2 + Cl2 = CH2Cl - CH2 - Cl.
Образующийся дихлорэтан путем нагревания в спиртовой щелочи при 80 - 90° С превращают в хлористый винил:
CH2Cl - CH2Cl = СН2 = СНСl + NaCl.
Хлористый винил является исходным сырьем для получения весьма распространенного и многотоннажного полимера — поливинилхлорида (ПВХ).
Основные продукты, получаемые переработкой алканов и алкенов, приведены на рисунке.
|
В настоящее время по методу Фишера-Тропша в Южно-Африканской Республике на трех заводах производят 4,5 млн т бензина в год. В республике нет своей нефти и синтез-газ получают конверсией каменного угля.
Схема процесса переработки синтез-газа:
1 - реактор газификации (t = 190 - 250°
С), Р = 0,5 - 2,5 МПа, Fe (Al2O3
- катализатор); 3 - ректификационная колонна. |
ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА. Синтез-газ в органическом синтезе начал использоваться после того, как в Германии Э. Фишер и Г. Тропш разработали (1922 - 1925) промышленный способ получения из него углеводородов и других органических соединений. Процесс состоит в нагревании синтез-газа в присутствии катализатора с последующим разделением продуктов реакции (углеводороды, спирты, кислоты). В зависимости от условий и типа катализатора образуются разные вещества.
|
Влияние катализатора на состав продуктов, получаемых из синтез-газа |
|||
| Катализатор | Т, °С | Давление, МПа | Продукты реакции |
| Fe на Al2O3, активированном МаОН | 190 - 250 | 1 - 3 | Алканы - от метана до высших твердых, алкены (этилен, пропилен, бутилены), спирты - от метанола до бутанола |
| Ni | 180 - 200 | 0,1 | Алканы - от метана до высших твердых |
| Со | 180 - 200 | 1,2 | Алканы - от метана до высших твердых |
При взаимодействии синтез-газа с непредельными соединениями (катализатор
Со(СО)2) образуются альдегиды, которые далее
перерабатывают в спирты и карбоновые кислоты. В настоящее время это
самый перспективный и высокопроизводительный способ производства высших
спиртов;
R - CH = CH2 + CО
→ H2R - CH2 - CH2-CHО
→ R - (CH2)2 - ОH.
В основе промышленной электрохимии лежат процессы, в которых химические реакции протекают под действием постоянного электрического тока. Электрохимическим способом получают хлор, щелочи, водород, кислород, окислители — перманганаты, персульфаты, перекись водорода, щелочные и щелочноземельные металлы (Be, Аl, Mg, Zn, Zr, Сu, Ni, W, Mo, U и др.) и некоторые органические соединения.
Электролизер — химический реактор для проведения электрохимического процесса — представляет собой ванну с двумя разноименными электродами, на которые подается постоянный ток. Схема электролизера представлена на рисунке. Для ускорения процессов электролиза реакторы оборудуют несколькими электродами, которые могут быть подключены к электрической цепи либо параллельно, либо последовательно. Монополярные электролизеры обеспечивают проведение процесса при больших токах и малых напряжениях, биполярные — наоборот. Во многих процессах анодное и катодное пространство разделено диафрагмой с целью отделения жидких и газообразных продуктов реакций. Диафрагмы изготавливают из пористого материала, пропускающего только ионы электролита, что исключает возможность протекания реакций с участием конечных и промежуточных продуктов на электродах противоположного знака и вблизи них. Для изготовления электродов используют графит, металлы, включая Нg и Pt. Газообразные продукты отводят в специальные приемники, жидкие — отбирают из катодного или анодного пространства с одновременной подачей свежего электролита в другой отсек. Процесс ведут непрерывно.
|
|
|
|
Принципиальная схема электролизера: 3 - электролит; 4 - диафрагма; 5 - анод; 6 - защитное покрытие ванны; 7 - ванна электролизера. |
Схема
подключения к цепи монополярного (а) и биполярного (б)
электролизеров: 2 -
катод; |
ЭЛЕКТРОЛИЗ раствора NaCl проводят в ваннах со стальным сетчатым или ртутным катодом, графитовым анодом и фильтрующей асбестовой диафрагмой. Процесс является непрерывным, его ведут при температуре 70 - 85° С и концентрации NaCl 310 - 315 г/л. На аноде образуется хлор, на катоде — водород, раствор обогащается щелочью до концентрации 110 - 120 г/л. После упаривания раствора из него выделяется непрореагировавший NaCl, а в растворе присутствует щелочь NaOH. Электролизом расплава NaCl получают металлический Na и газообразный Cl2.
ПРИ ЭЛЕКТРОХИМИЧЕСКОМ ПОЛУЧЕНИИ АЛЮМИНИЯ электролитом служит расплавленный глинозем Al2O3 с добавкой 12 - 15% криолита На3АlF6 для понижения температуры плавления. Электролиз ведут при температуре 1000° С. Открытая металлическая ванна футерована огнеупорным кирпичом и угольными плитами. Дно ванны из угольных блоков является катодом. Анодная масса из смеси антрацита, кокса, каменноугольной смолы и пека помещена в атиоминиевый кожух. Напряжение на ванне составляет 5 В, нагрузка на электроды 40 - 150 тыс. А, выход по току — 90%, расход электроэнергии — 15 - 20 тыс. кВт х ч на 1 т Аl. Алюминий извлекают из ванны один раз в 3 - 4 суток, далее он подвергается переплавке в слитки, в которых его содержание равняется 99,8%. Для получения металла высокой степени чистоты — 99,99% — технический Аl рафинируют.
|
Электрохимический метод получения водорода и кислорода электролизом воды требует большого расхода электроэнергии и поэтому не реализован в производстве. Экономически более доступным методом получения водорода является конверсия углеводородов. Кислород производится из воздуха при низких температурах, одновременно можно получить также азот и аргон. Электролиз воды используют, когда нужны чистые газы. Для электролиза применяют водные растворы щелочей (NаОН, КОН) или кислот (H2SO4), при этом на аноде выделяется кислород, а на катоде - водород.
Схема электролитической ванны для получения алюминия: 6 - застывший электролит;
7 - расплавленный электролит; |
РАФИНИРОВАНИЕ -это процесс анодного растворения очищаемого металла с последующим его осаждением на катоде. Чистота металла при такой очистке достигает > 99%. Анод представляет собой отливку очищаемого металла, катод — пластинку чистого металла. Например, в процессе рафинирования черновой меди, производимой из сульфидных руд, из нее отливают аноды весом до 350 кг, катодом является пластинка из чистой электролитической меди, электролитом — раствор CUSO4, подкисленный H2SO4. Процесс ведут при температуре 55° С, продолжительность его составляет 20 - 30 дней.
Современные наукоемкие технологии, используемые в микроэлектронике, космической, атомной и лазерной технике и других областях, предъявляют очень высокие требования к чистоте материалов.
|
Оптические волоконные материалы все шире используются в технике для передачи информации (световодные системы связи, измерительная аппаратура, средства управления и контроля технологических процессов и т. д). Материалы, из которых изготавливаются оптические каналы связи большой протяженности, в идеале не должны поглощать свет. Поглощение света приводит к оптическим потерям и снижению эффективности связи, В оптических волокнах, приготовленных из аморфных органических полимерных материалов, оптические потери не превышают 10-2 - 10-4 см-1. Поэтому мономеры, из которых получают исходные полимеры для изготовления оптических волокон, подвергают тщательной очистке.
Турбина самолета. |
ТРАДИЦИОННЫЕ ХИМИЧЕСКИЕ технологии не позволяют получить сверхчистые вещества. А в материалах для волоконной оптики, например, содержание примесей должно быть не более миллиардных долей процента. Поэтому для получения сверхчистых веществ разработаны специальные технологии.
Зачастую требования к чистоте ограничиваются пределом чувствительности современных методов анализа. К особо чистым относят такие вещества, содержание примесей в которых составляет менее 10-1 атомных (ат.) %.
Иногда количество примесей оценивают содержанием атомов примесного элемента в единице объема вещества. Неорганические примеси указываются маркой «осч», за которой стоит число примесей и отрицательный десятичный логарифм их суммарного процентного содержания. Органические примеси обозначают маркой «оп» и отрицательным десятичным логарифмом их суммарного процентного содержания. Производство таких веществ является малотоннажным и исчисляется граммами или килограммами. Для глубокой очистки вещества применяются различные физико-химические методы: осаждение, комплексообразование, избирательное окисление/восстановление, многократная ректификация и перекристаллизация, зонная плавка, сорбция, экстракция, электроэкстракция, ионный обмен и др.
В ТЕХНОЛОГИЯХ СВЕРХЧИСТЫХ ВЕЩЕСТВ высокие требования предъявляются к чистоте реактивов, воды, растворителей, воздуха и материалов, из которых изготовлено технологическое оборудование.
Методом многократной перекристаллизации вещества удается очистить его от большинства примесей. Обычно технологический процесс проводят в специальных камерах или боксах, в которые очищенные вещества герметично упаковываются.
| В газовых лазерах
применяются как нейтральные атомы гелия, меди, иода, так и
стабильные молекулы оксида и диоксида углерода, фторида водорода,
азота, инертные газы - аргон, криптон и их фториды, а также ионы
аргона, криптона, неона. Кроме этого, применяются пары металлов. В твердотельных лазерах используются диэлектрические кристаллы и стекла, получаемые на основе оксидов иприя и алюминия, гадолиния и вольфрама, бериллия и алюминия с редкоземельными элементами, чаще всего с неодимом, а также калием, литием, селеном, хромом и др. Кристаллы иттрий-алюминиевого граната с неодимом по эксплуатационным свойствам превосходят многие другие. |
|
|
|
|
|
Схема
зонной плавки: |
Применение лазера в промышленном производстве. |
Твердые вещества, плавящиеся без разложения, очищают методом зонной плавки. Стержень из очищаемого вещества нагревают в специальной печи и медленно продвигают его через зоны плавления и охлаждения. При многократном повторении этой операции более легкоплавкие примеси собираются в головке стержня, которую затем удаляют. Так очищают Ge и Si для полупроводников, транзисторов, фоторезисторов, солнечных батарей и др.
При электроэкстракции металлов вещества для приготовления электролита вода и материал, предназначенные для изготовления электродов, также должны быть высокочистыми.
Твердые летучие вещества очищают методом сублимации — при нагревании до температуры плавления они возгоняются и осаждаются на охлаждаемой поверхности. Процесс проводят в вакууме. Многократным повторением такой операции получают вещества высокой чистоты. Производство и формование волокон из полиамидных смол — капрона и нейлона — осуществляются при высокой температуре 260 - 280° С в атмосфере азота. При этом содержание кислорода в азоте не должно превышать 10-5%. Очистку азота проводят в присутствии небольшого количества водорода, во избежание образования гремучей смеси, при 500° С в присутствии Сu- или Pd-катализатора. Используемые катализаторы также должны быть сверхчистыми.
МАТЕРИАЛЫ ДЛЯ ЛАЗЕРОВ. Лазеры находят все большее
применение в технике, при проведении научных исследований и в медицине.
Кристаллы для лазеров выращивают направленной кристаллизацией из расплавов;
стекла изготовляют в керамических и платиновых сосудах. Количество примесей не
должно превышать 10-3 - 10-4%.
В современном мире полимерные материалы благодаря разнообразию физико-химических и механических свойств нашли чрезвычайно широкое применение.
| По ряду физико-механических и физико-химических свойств полимерные материалы превосходят многие металлы. Например, удельная прочность полиэтиленовой нити на разрыв превышает прочность стальной нити почти в 10 раз. Полимерные материалы легко перерабатываются в изделия. Потеря исходного материала в процессе переработки составляет 5%, в то время как при изготовлении стальных деталей в стружку уходит до 70% металла. Стоимость полимерных материалов в несколько раз ниже стоимости металлов. |
ТЕХНОЛОГИЯ полимерных материалов включает в себя три группы: синтез полимеров, получение из них различных полимерных материалов и переработка полимерных материалов. Это реакции полимеризации, поликонденсации и полиприсоединения (поликонденсация, не сопровождающаяся выделением низкомолекулярных веществ), а также реакции химической модификации полимерных молекул.
Способы получения полимерных материалов определяются структурой и физико-химическими свойствами исходных мономеров или полимерных молекул. Подбирая мономерные и полимерные молекулы с активными функциональными группами, способные вступать в реакции полимеризации или полиприсоединения, получают различные гетероцепные, привитые или блоксополимеры с требуемыми характеристиками. Полимерные материалы содержат также различные добавки: пластификаторы, красители, загустители, разбавители, светостабилизаторы, антиоксиданты и др. Их вводят либо на стадии синтеза, либо непосредственно в готовый полимер. Таким образом обеспечивается придание полимерным материалам необходимых технических и эксплуатационных характеристик.
Технология переработки полимерных материалов состоит из операций и приемов, с помощью которых исходные полимерные материалы превращаются в изделия, пригодные для эксплуатации.
| Основная задача катализаторов и инициаторов полимеризации состоит в том, чтобы создать в реакционной массе активные центры, на которых начинается процесс полимеризации. Катализаторы помогают снизить себестоимость производства за счет сокращения энергозатрат и продолжительности процессов. Основные типы катализаторов, используемых в производстве полимеров, представлены в таблице. |
ПОЛУЧЕНИЕ ПОЛИМЕРОВ. В промышленности реализованы и используются все способы синтеза полимерных макромолекул. До 80% полимеров получают реакцией полимеризации в присутствии катализаторов или инициаторов полимеризации.
Если полимеризация протекает по радикальному механизму, в качестве инициаторов реакции используют либо физические воздействия, приводящие к образованию свободных радикалов (свет, радиактивное излучение и др.), либо химические вещества, распадающиеся с образованием свободных радикалов (перекись водорода, перекись органических кислот и др.), либо используют оба фактора (например, кислород и воздействие света и др.).
Инициаторы ионной полимеризации, в отличие от катализаторов, не остаются в неизменном виде, а входят в виде концевых групп в состав образующейся полимерной молекулы.
| Основные типы катализаторов и примеры их использования в производстве полимеров | ||
| Тип катализатора | Катализатор | Примеры производства |
| Ионный (катионная полимеризация) | Акцепторы электронов или электронных пар (HF, H2SO4, AlCl3, FеСl, BF3 и др.) | Полиизобутилен (-90° С), бутилкаучук (-90... -96° С) |
| Ионный (анионная полимеризация) | Доноры электронов (щелочные металлы, их алкоголяты, NаNН2, другие основания) | Синтетические каучуки (5 - 65° С, атмосферное давление) |
| Металлокомплексные | Соединения металлов IV - VIII групп (ТiCl3, NiCl4, VCl4, ZrCl4, NiCl2 и др.), АL(С2Н5)2Сl/TiСl4 (Циглера - Натта) | Полиэтилен, стереорегуляторные полимеры, оптически активные полимеры, каучуки (65 - 85° С, 0,3 - 1,0 МПа) |
Сополимеризация позволяет разнообразить структуру полимерных молекул,
получаемых реакцией полимеризации. В этом случае в реакцию полимеризации вводят
смесь мономеров в определенном соотношении.
Так, при суспензионной полимеризации стирола (40%), метилметакрилата (52,5%) и акрилонитрила (7,5%) получают водостойкий, бензиностойкий, легко окрашивающийся сополимер (марки МСН), широко применяемый в автомобильной и радиотехнической промышленности.
| Повышение активности катализатора приводит к значительному увеличению основного параметра процесса - выхода полимера на единицу массы катализатора. Катализаторы Циглера - Натта первого поколения имели относительно небольшую эффективность - съем полимера на 1 г катализатора составлял менее 1 кг. Катализаторы второго поколения обладали высокой удельной поверхностью, что позволило увеличить выход полимера до 10 - 15 кг на 1 г катализатора. Дальнейшее усовершенствование катализаторов этого типа привело к созданию катализаторов третьего поколения, обеспечивающих съем полимера до 300 кг на 1 г катализатора. |
Реакцией поликонденсации получают ряд важнейших полимеров, в
частности полиамиды и полиэфиры, которые применяются для производства волокон,
тканей и других распространенных в быту и промышленности материалов. Основой
процесса химической модификации полимерных молекул является замещение атома
водорода у атомов С, О или N полимерной молекулы. При этом
образуются полимерные материалы с новыми свойствами и структурой, которую
практически невозможно получить другими реакциями. В результате химической
модификации образуются полимерные молекулы, структура которых собрана из
нескольких макромолекул.
Полимеризацию осуществляют в газовой или жидкой фазе (растворах, суспензиях, эмульсиях). Выбор способа полимеризации определяется свойствами мономера и желаемыми физическими характеристиками продукта реакции.
| Реактором в процессе получения ПЭВД служит змеевик (труба в трубе) длиной от 350 до 1500 м и диаметром внутренней трубы от 16 до 74 мм. Снаружи труба обогревается водой, нагретой до 250° С. Процесс полимеризации циркуляционный, выход ПЭВД при однократном проходе через реактор составляет 20 - 30%. Полиэтилен нерастворим при нормальной температуре в органических растворителях, устойчив к действию концентрированных кислот и щелочей (кроме азотной кислоты). Половина его перерабатывается на пленку, которая широко применяется для упаковки продуктов и в сельском хозяйстве. |
ГАЗОФАЗНАЯ ПОЛИМЕРИЗАЦИЯ применяется в случае использования газообразных мономеров — этилена, пропилена и др. Ее осуществляют при высоких температурах и давлениях в присутствии инициаторов полимеризации — кислорода или перекисных органических соединений. Образующийся полимер находится в расплавленном состоянии, его охлаждают (обычно водой), сушат и гранулируют. На рисунке приведена схема производства полиэтилена высокого давления (ПЭВД). Полиэтилен низкого (ПЭНД) и среднего давления (ПЭСД) получают в присутствии растворителей (бензин, циклогексан) при низких температурах (80 - 160° С) и давлениях 0,5 - 4 МПа. Катализаторы — Циглера — Натта Аl(С2Н5) х TiCl4 и оксид хрома СгО3. Полимер выпадает в осадок, и после отмывки катализаторов его сушат и направляют на переработку.
|
Условия получения и характеристики полиэтиленов |
|||
|
Параметр |
ПЭВД низкой плотности |
ПЭВД высокой плотности |
ПЭСД |
|
Среда |
Газовая фаза |
Органический растворитель |
|
|
Температура, °С |
200 - 280 |
70 - 80 |
160 - 80 |
|
Давление, МПа |
150 - 300 |
0,15 - 0,5 |
3,5 - 4,0 |
|
Концентрация инициатора/ катализатора, % |
Кислород (0,002 - 0,008) |
Циглера-Натта, 061 |
СгО3 (0,1) (0,1) |
|
Плотность, кг/м3 |
910 - 930 |
950 - 960 |
960 - 970 |
|
Число СН3-групп на 1000 атомов С |
14,4 |
1,0 |
1,0 |
|
Кристалличность |
50 - 65 |
85 - 90 |
80 - 90 |
|
Молекулярная масса, х 103 |
80 - 500 |
80 - 3500 |
300 - 400 |
| Удлинение при растяжении, % | 500 - 600 | 300 - 800 | 200 - 800 |
| Температура плавления, ° С | 105 - 108 | 120 - 125 | 127 - 130 |
|
Температура хрупкости, ° С |
80 - 120 |
100 - 150 |
70 |
БЛОЧНУЮ ПОЛИМЕРИЗАЦИЮ проводят в жидкой фазе в отсутствие растворителя. Продуктом реакции является мелкодисперсный порошок или твердая масса полимера. Полимеризацию проводят при нагревании в присутствии перекисных соединений. Примером блочной полимеризации может служить процесс получения полистирола.
| Полистирол - термопластичный материал. Его получают полимеризацией непредельного ароматического углеводорода стирола. При производстве полистирола применяют методы блочной, суспензионной и эмульсионной полимеризации. В зависимости от способа производства изменяются свойства получаемого полимера, его молекулярная масса и термическая стабильность. Полистирол - хороший диэлектрик, химически стабилен, водостоек. Блочный полистирол бесцветен, прозрачен, пропускает 90% видимой части света и применяется для изготовления оптических стекол. |
ПОЛИМЕРИЗАЦИЮ В РАСТВОРЕ осуществляют при нагревании в присутствии инициаторов или катализаторов. Если полимер хорошо растворяется в растворителе или мономере, то в результате образуется вязкий раствор — лак. Его можно применять непосредственно для покрытия изделий. Если полимер необходимо выделить, в лак добавляют другой растворитель, в котором полимер нерастворим. Если в растворителе растворяется только мономер, а полимер не растворяется, то образуется мелкодисперсный порошок. Его отфильтровывают, промывают и высушивают.
СУСПЕНЗИОННУЮ ПОЛИМЕРИЗАЦИЮ проводят в воде в присутствии эмульгаторов (поливиниловый спирт, растворимые в воде простые эфиры целлюлозы, желатин, глина и др.). В приготовленную среду вводят мономер вместе с инициатором полимеризации. Процесс протекает при нагревании и интенсивном перемешивании. Полимер образуется в виде порошка, который отделяют, промывают и сушат.
|
Принципиальная схема производства ПЭВД: 5 - гранулятор полиэтилена. |
ПРИ ЭМУЛЬСИОННОЙ ПОЛИМЕРИЗАЦИИ в качестве дисперсионной среды используют воду, туда вводят инициатор. Эмульсии стабилизируют, добавляя ионные эмульгаторы — соли карбоновых и сульфокислот. Полимеризацию проводят при нагревании, интенсивном перемешивании и постоянном значении показателя pH. Процесс протекает с высокой скоростью, его выделяющийся в жидком виде полимер образует стабильную эмульсию. По окончании процесса вводят деэмульгаторы (кислоты или соли), полимер выпадает в осадок, его отделяют и обрабатывают. Молекулярная масса полимера велика: от нескольких сот тысяч до 1 - 2 миллионов.
| Пенополистирол имеет структуру застывшей пены. Прочностные свойства его определяются размером и формой внутренних ячеек и толщиной их стенок. Механические свойства пенополистирола зависят и от способа полимеризации: так, полимер, полученный суспензионной полимеризацией стирола, менее прочен, чем образовавшийся по эмульсионному способу. Пенополистирол обладает высокой горючестью. Для устранения этого недостатка в ходе полимеризации вводят хлорпроизводные или добавляют специальные добавки, например оксид сурьмы. В результате горючесть пенополистирола снижается или устраняется вовсе. |
ПОЛУЧЕНИЕ ПОЛИМЕРНЫХ МАТЕРИАЛОВ. Высокомолекулярные вещества, которые образуются в результате химических реакций, еще не готовы для практического использования. Такие вещества не имеют окраски, способны окисляться или изменять свои физические характеристики при хранении в реальных условиях и т. д. Выше уже говорилось, что полимерные материалы — это многокомпонентные системы. Их получают, вводя в исходные вещества необходимые добавки. Часто это удобно делать на этапе образования расплавленного или растворенного полимера, что позволяет сразу получать готовый полимерный материал. В качестве примера можно привести процесс ПЭВД.
|
Схема непрерывного процесса производства полистирола: |
Введение в суспензионный полистирол вспенивающего агента, например на последней стадии полимеризации стирола, позволяет получить пенополистирол — прекрасный тепло- и шумоизолирующий материал. Он устойчив к воздействию влаги и агрессивных сред и отличается высокой биологической устойчивостью — на нем не размножаются бактерии, грибки. На рисунке представлена принципиальная схема непрерывного процесса получения пенополистирола.
Интересен процесс получения другого пенопласта — пенополиуретана. Вспенивающим агентом в данном случае является диоксид углерода, выделяющийся в результате реакции поликонденсации, в которую вступают полиизоцианаты и гидроксилсодержащие полиэфиры в присутствии катализатора — третичных аминов.
В смесь вводят стабилизаторы пены, красители и др. После застывания пены образуется готовый полимерный материал, относящийся к семейству пенопластов.
 |
 |
 |
| Виды химических волокон. | ||
ПЕРЕРАБОТКА ПОЛИМЕРОВ И ПОЛИМЕРНЫХ МАТЕРИАЛОВ. Полученные полимеры и полимерные материалы в результате переработки превращают в изделия. Для этого используют разнообразные физические методы: литье в подготовленные формы, прокатывание размягченного полимера через валки для превращения его в пленку, прессование под давлением, различные виды механической обработки и т. д.
Продавливание расплавленного полимера через отверстия определенного диаметра — фильеры — приводит к образованию нитей. Нити можно получить и направляя тонкую струю раствора полимера в воду, в которой полимер нерастворим. Такие нити называются химическими волокнами. Они могут быть как искусственными — получаемыми переработкой природных полимеров (целлюлозы, белка, силикатов), так и синтетическими — производимыми из синтетических полимеров.
Из синтетических больше всего выпускают полиамидных волокон — капрона, нейлона, из полиэфирных — лавсана, терилена, полиакрилонитрильных — нитрона.
Для получения высокопрочных и высокотермостойких
материалов, применяемых в авиации и ракетной технике, созданы волокна с
уникальными свойствами — углеродные, борные, карбидные, кварцевые, алмазные и
др. Основным преимуществом химических волокон по сравнению с природными является
широкая сырьевая база, рентабельность производства и независимость от
климатических условий. Химические волокна обладают более высокими механическими
свойствами (прочностью, эластичностью, износостойкостью) и сохраняют их во
влажном состоянии, кроме того, они меньше мнутся. К недостаткам некоторых из них
относится низкая гигроскопичность.
Генная инженерия — это технология, позволяющая манипулировать молекулами ДНК вне организма, in vitro. Технология генной инженерии преодолела барьер живой природы, в которой передача генетической информации осуществляется только среди близкородственных организмов, т. е. относящихся к одному виду.
|
In vitro - в стекле (лат.) -специальный термин, указывающий на то, что данный процесс или явление происходит вне живого организма (в пробирке, колбе). In viva - в живом (лат.) - специальный термин, который указывает, что данный процесс или явление происходит в живом организме.
|
В СЕРЕДИНЕ 1970-х гг. были выяснены механизмы воспроизводства генетической информации и механизмы реализации информации, закодированной ДНК, а также основные закономерности процесса синтеза белка. Оказалось, что ряд особенностей данных механизмов позволяет переносить гены из одного организма в другой и заставляет их работать в чужом организме.
Для генной инженерии важно, что ферменты репликативного комплекса безразличны к последовательностям нуклеотидов, расположенных между точками начала и окончания репликации. Иными словами, если между этими точками ввести новый, даже чужой ген, то репликативная машина, ничего не заметив, будет удваивать этот ген, как свой собственный. Существование такого механизма позволяет направленно встраивать в ДНК необходимые гены, что составляет основу генной инженерии.
Если генетический код универсален, то регуляторные последовательности достаточно специфичны для данного вида организмов. Это означает, что ген человека, встроенный в ДНК бактерии вместе со своими регуляторными областями, будет воспроизводиться при размножении бактерий, будет подвергаться копированию в РНК, т. е. будет молчать, так как бактериальная РНК-полимераза не узнает человеческие регуляторы последовательности перед геном. Однако если создать конструкцию ДНК, в которой структурный ген белка человека будет встроен сразу за регуляторной областью бактериального гена, то бактериальная РНК-полимераза узнает свою регуляторную последовательность и осуществит копирование чужого гена.
|
И в живой природе происходит генетический обмен. |
Такая же схема справедлива и для биосинтеза белка на мРНК. Специфические последовательности на мРНК означают место посадки рибосом и начало синтеза белка, и, как мы уже говорили, три кодона означают конец синтеза. Если такие последовательности присутствуют, то рибосомы прочитают любой, в том числе и чужой для организма, ген.
Генная инженерия является техникой создания in vitro таких химерных (рекомбинантных) конструкций ДНК, которые содержат структурный ген одного организма и регуляторные области организма хозяина, в который такая конструкция вводится.
В живой природе происходит генетический обмен. Например, при половом размножении происходит обмен фрагментами ДНК между хромосомами родителей. Обязательным условием при этом является сходство нуклеотидных последовательностей в двух молекулах ДНК, подвергающихся процессу обмена (гомология). Технология же генной инженерии не требует такой гомологии.
| Впервые получил рекомбинантную
молекулу ДНК американский биохимик П. Берг в 1972 г. Это событие
считают датой возникновения технологии генной инженерии. Генная инженерия - совокупность приемов, позволяющих выделять отдельные гены, объединять их, вводить в живые клетки. Теперь можно изолировать любой ген, в «пробирке» произвести в нем изменения в нужном месте и снова вернуть в микроорганизм. Можно ввести в микроорганизм «чужой» ген или гены и заставить клетку производить вещества, которые она сама по себе не могла никогда делать. Разве это не удивительно? |
ГЛАВНЫМ ИНСТРУМЕНТОМ генной инженерии являются рестриктазы. Толчком к развитию методологии генной инженерии явилось открытие ферментов, получивших название рестриктирующие нуклеазы или рестриктазы. Это ферменты бактерий, которые защищают клетку от чужеродных молекул ДНК. Механизм такой защиты основан на расщеплении двухспиральных молекул ДНК в определенных точках биополимера. Рестриктазы «узнают» определенные последовательности нуклеотидов в молекуле ДНК, состоящие из 4 - 6 пар нуклеотодов, и «разрезают» ее на рестрикционные фрагменты. Длина таких фрагментов определяется положением узнаваемых участков в молекуле ДНК. Их можно разделить методом электрофореза в полиакриламидном геле, где деление осуществляется по их размерам (молекулярному весу фрагментов) и заряду. Далее фрагменты ДНК можно снова сшить, используя фермент ДНК-лигазу. Часто рестриктазы образуют фрагменты с комплементарными «липкими» концами, что облегчает их сшивку. При этом ясно, что фрагменты ДНК, полученные из любых источников и расщепленные одной и той же рестриктазой, будут объединяться на базе их «липких» концов. В настоящее время существуют и другие совершенные способы получения фрагментов ДНК со строго определенной последовательностью и методы их объединения с точностью до одного нуклеотида. Таким образом возможно in vitro создавать конструкции ДНК, «встраивая» интересующий нас ген из любого источника.
|
Нарушение в генной механизме наследственности
приводит |
Для переноса таких генно-инженерных конструкций в организм часто используют небольшие молекулы ДНК вирусов, бактериофагов (вирусов бактерий) или плазмидные ДНК. Плазмиды — это небольшие кольцевые молекулы ДНК, существующие у многих бактерий и дрожжей в дополнение к хромосомам. Такие небольшие молекулы ДНК называются векторами. Разработаны удобные векторные системы для переноса генов в бактерии, дрожжи, растения и высшие организмы животных и человека. Существуют и методы интеграции чужеродной генетической информации непосредственно в хромосомы.
|
Генная инженерия позволяет создавать устойчивые к болезням растения с улучшенными пищевыми качествами. |
Генная инженерия широко применяется для создания растений, устойчивых к гербицидам, вирусам, насекомым и вредителям, с повышенными пищевыми и технологическими качествами, для улучшения штаммов-продуцентов в микробиологическом производстве ферментов, аминокислот, антибиотиков, витаминов. Но особенно велики реальные успехи генной инженерии в медицине — создание новых лекарств и вакцин, генотерапия.
НАИБОЛЕЕ ЗНАЧИТЕЛЬНЫЕ ДОСТИЖЕНИЯ генной инженерии связаны с переносом генов животных и человека в клетки микроорганизмов. Мы уже рассмотрели примеры использования микроорганизмов в промышленных масштабах, т. е. в процессах получения тех веществ, которые микроорганизмы синтезируют в природе. Техника генной инженерии позволяет внедрять в геном микроорганизма «чужие» гены, например гены человека или животного, и тем самым заставлять клетку производить вещества, которые она сама по себе не могла бы синтезировать. Такой подход позволил получать с помощью микробиологического синтеза белки человека и животных, которые можно использовать в лечебных целях.
|
Получение штамма Е. coli,
способного синтезировать гормон роста человека. |
НЕКОТОРЫЕ ЗАБОЛЕВАНИЯ ЧЕЛОВЕКА возникают в связи с заражением организма патогенными микроорганизмами (чума, холера, туберкулез и т. д.) или вирусами (грипп, гепатит, СПИД). Но есть другие, не менее тяжелые заболевания, обусловленные тем, что организм человека имеет врожденный или приобретенный дефект в выработке определенных белков. Например, недостаток в организме гормона роста вызывает карликовость. Недостаток гормона инсулина приводит к возникновению тяжелой болезни — сахарного диабета. Такие болезни можно лечить, вводя в организм недостающий белок. К сожалению, большинство белков видоспецифично, т. е. гормон роста человека отличается по последовательности и составу аминокислот от гормона роста свиньи, коровы, овцы, а последние — друг от друга. Введение чужеродного белка воспринимается иммунной системой как атака на организм, который она защищает. В результате реакции иммунной системы на такое вторжение (иммунный ответ) вырабатываются специфические антитела, связывающие чужеродный белок и нейтрализующие его биологическую активность. Таким образом, в организм человека можно вводить без нежелательных последствий «человеческие» белки. Понятно, что источник таких белков ограничен, так как их можно получить только от здоровых людей, например погибших в катастрофе. На помощь пришла генная инженерия.
ГЕН ЧЕЛОВЕКА, ответственный за синтез проинсулина, внедрен в геном микроорганизма, и таким образом создан штамм-продуцент проинсулина (предшественник инсулина) человека. После соответствующей обработки из проинсулина получают инсулин. Инсулин стал одним из первых белков, которые попытались получить методами генной инженерии. Создание рекомбинантного штамма сделало источник инсулина практически неисчерпаемым.
| До тех пор пока в 1921 г.
канадскими учеными Ф. Бантингом и Ч. Бестом не был открыт инсулин,
диабет являлся неизлечимой смертельной болезнью. Очень скоро после
открытия инсулина были разработаны методы получения его из
поджелудочных желез свиней. Оказалось, что белок свиньи отличается
от человеческого только одной аминокислотой, и поэтому свиной
инсулин воспринимается организмом человека как «свой» белок.
Инсулинотерапия позволила больным сахарным диабетом вести нормальный
образ жизни. К сожалению, сахарный диабет быстро распространяется и
молодеет, он даже встречается у молодых чаще. Сегодня диабетом
больны на планете сотни миллионов людей. В 1978 г. ученые генно-инженерной фирмы «Генетех» из США сообщили об успешном синтезе человеческого инсулина бактериями. Десять лет ушло на отработку технологии и клиническую проверку безвредности и эффективности препарата. И в 1988 г. американская фармацевтическая компания «Эли-Лили» выпустила на рынок препарат человеческого инсулина (коммерческое название «Хемулин»), произведенного методом микробиологического синтеза. |
ГОРМОН РОСТА появился на рынке лекарственных препаратов в начале 90-х гг. Этот гормон был получен с помощью рекомбинантного штамма микроорганизма, содержащего соответствующий человеческий ген. С появлением генно-инженерного гормона роста проблема карликовости была решена (по крайней мере в развитых странах). Гормон роста эффективен и в тех случаях, когда в организме протекают процессы регенерации (восстановления), например, костной ткани после переломов, кожи после ожогов и др. Методами генной инженерии получены также гормоны роста коров и свиней. Для этого в геном микроорганизма-продуцента встраивают соответствующие гены животных. Гормон роста коров используется для повышения их удойности, а гормон роста свиней — для более быстрого роста животных и получения нежирного мяса. Употребление мяса таких животных в пищу безвредно, так как сам гормон роста — это белок, который разрушается в пищеварительном тракте до аминокислот. Генно-инженерные гормоны роста человека и сельскохозяйственных животных широко используются в медицине и сельском хозяйстве. К лекарствам, полученным с помощью генной инженерии, относятся также эритропоетин (белок, участвующий в кроветворении и применяемый при лечении анемий) и факторы роста клеток — GCSF и GMCSF. Они применяются для стимуляции кроветворных процессов в организме. Продажа таких препаратов в мире превышает по стоимости продажу антибиотиков.
ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ. Лечение вирусных инфекций (от простого гриппа до СПИДа) всегда было актуальной проблемой медицины, поскольку ни антибиотики, ни другие антибактериальные препараты на вирусы не действуют. Организм человека и высших животных имеет два барьера, две системы борьбы с проникшим в него вирусом. Первый барьер — это система быстрого реагирования, которая действует в течение первых часов и дней после попадания вирусной инфекции и обеспечивается выработкой в организме в ответ на вирусную инфекцию специальных противовирусных белков, называемых интерферонами. Второй, более мощный и фундаментальный барьер — это иммунная система организма, вырабатывающая специфические иммуноглобулины, связывающие и нейтрализующие вирус. Вторая система вступает в действие только на 5 - 7-е сутки после проникновения инфекции.
Интерфероны вырабатываются зараженной вирусом клеткой, выделяются в кровь и делают соседние клетки организма не чувствительными к вирусной инфекции.
| Интерфероны - группа белков,
образующихся в клетках животных и человека при воздействии на них
вирусов и обеспечивающих неспецифический противовирусный иммунитет
(иммунитет против разных вирусов). Свое название интерфероны
получили вследствие того, что открыли их. исследуя феномен
интерференции. Было показано, что мыши, зараженные вирусом гриппа,
не чувствительны к инфицированию другим, более опасным вирусом.
Оказалось, что в крови зтих мышей присутствуют некие антивирусные
белки, которые и получили название интерферона. В 1 л питательной среды, в которой культивировались рекомбинантные микроорганизмы, присутствует такое же количество интерферона, которое содержится в 1 т донорской крови. Разные клетки организма вырабатывают несколько различных интерферонов. Так, лейкоциты (белые клетки крови) вырабатывают α-интерфероны, фибробласты (клетки кожи) β-интерфероны. Наиболее широко в медицинской практике используется α-интерфероны. В настоящее время генно-инженерный α-интерферон под различными коммерческими названиями производится многими фармацевтическими компаниями на сумму, превышающую 3 млрд $ США в год, и используется при лечении разного рода инфекций (гриппа, гепатита, герпеса), а также онкологических заболеваний. |
ИНТЕРФЕРОНЫ — это противовирусные агенты. Их спектр действия очень широк — они защищают организм от любых вирусов. К сожалению, эти белки видоспецифичны: интерферон человека действует только в человеческом организме, а интерферон мыши — в мышином и т. д. Интерфероны биологически очень активны и содержатся в крови людей в ничтожных количествах. Поэтому применение интерферонов в медицине было ограниченно, так как основным источником являлась дефицитная донорская кровь. И снова на помощь пришла генная инженерия. Ген человеческого α-интерферона был перенесен в геном бактериальной клетки, и бактерии начали производить человеческий интерферон. Процесс выращивания микроорганизмов занимает всего 18 - 20 часов, причем бактерии растут на простых средах, содержащих минеральные соли и глюкозу.
ЖИВОТНЫЕ тоже могут синтезировать белки человека. Источником генно-инженерных белков человека могут быть не только микроорганизмы, но и животные. Созданы трансгенные животные (в их ДНК встроен нужный ген другого вида, например человека) — овцы, козы, которые выделяют в молоко человеческие белки. У подобных животных структурный ген человеческого белка встроен так, что синтез белков человека осуществляется только в молочной железе и только в период лактации. Таким образом, выделение белка человека с молоком никак не сказывается на животном. Ряд белков удобно получать именно этим способом.
ГЕННАЯ ИНЖЕНЕРИЯ И ПРОИЗВОДСТВО ВАКЦИН. Основной системой организма, борющейся с проникшими в организм бактериями и вирусами, является иммунная система. Она обладает способностью вырабатывать специфические белки — иммуноглобулины, или антитела. И бактерии и вирусы имеют на своей поверхности белки, которые «узнает» иммунная система человека. После связывания с антителами вирусов и бактерий образуются агрегаты, которые поглощаются и перевариваются специальными клетками крови — фагоцитами.
|
Применение гормона роста увеличивает удойность коров на 15%. |
В нормальном неинфицированном организме существует популяция лейкоцитов, вырабатывающих чрезвычайно разнообразные антитела. Каждый лейкоцит вырабатывает определенные антитела с определенной специфичностью.
Иммунная система обладает двумя очень интересными особенностями — способностью к индукции и памятью.
Если до инфекции доля лейкоцитов с определенной специфичностью составляет тысячные и десятитысячные доли процента, то после инфекции и индукции доля «специфических» лейкоцитов может возрасти уже в 1000 и 10000 раз. Соответственно в крови начинает циркулировать заметное количество антител против инфекционного агента. Это и есть иммунный ответ. Феномен памяти заключается в том, что при повторной инфекции, даже с промежутком в годы, иммунный ответ развивается быстрее и эффективнее, чем при первичной инфекции. На этих двух особенностях иммунной системы основан метод вакцинации, т. е. предохранения организма от заболеваний с помощью прививок (вакцины).
|
Вакцины -
препараты, используемые для прививки от инфекционных заболеваний
Вакцины содержат болезнетворные вирусы и бактерии, инактивированные
путем нагревания или химической обработки. Иногда используют и живые
вакцины - болезнетворные микроорганизмы с ослабленной способностью
вызывать заболевания. Вакцинация предохраняет людей от туберкулеза,
кори, дифтерии, коклюша, бешенства, столбняка, оспы и других
заболеваний. |
ГЕННО-ИНЖЕНЕРНЫЕ ВАКЦИНЫ. Большим неудобством при приготовлении вакцин является необходимость выращивания опасных болезнетворных вирусов и бактерий. И здесь на помощь пришла генная инженерия. Ученые заставили непатогенный микроорганизм синтезировать белки, характерные для болезнетворного вируса или бактерии, т. е. в безопасную бактерию перенесли ген патогенного микроорганизма (сами эти гены и их продукты не способны вызывать заболевания). Таким образом упрощается система производства вакцин. В последние годы генно-инженерные вакцины начали повсеместно использоваться в медицине, ветеринарии и рыборазведении.
ДНК-ВАКЦИНАЦИЯ представляет собой следующий этап разработки вакцин нового поколения. Суть ДНК-вакцинации заключается в том, что ген вируса вводят в клетки человека, заставляя его там работать. При этом в организме человека вырабатываются антитела против вирусного белка, которые атакуют соответствующий вирус в случае инфекции. В таких конструкциях перед геном вирусного белка помещают регуляторные последовательности, которые позволяют ферментам человеческой клетки правильно читать вирусный белок. ДНК-вакцинация оказалась возможной после открытия того факта, что некоторые, но не все клетки человека могут поглощать чужеродную ДНК.
К таким клеткам относятся клетки эпидермиса (подкожный слой) или миоциты (клетки мышечной ткани).
|
В здоровом организме ежедневно образуются тысячи ненормальных клеток, которые ликвидирует иммунная система. Возникновение раковой опухоли - это сбой иммунной системы организма, которая по каким-то причинам «проглядела» появление ненормальной клетки. Есть основания полагать, что с помощью ДНК-вакцин можно будет активизировать атаку иммунной системы на клетки опухоли. Такие вакцины сегодня конструируют и проверяют.
Промышленное производство лекарственных препаратов. |
ДНК-вакцинацию можно осуществить либо введением раствора ДНК с помощью инъекции в мышцу или царапины на коже (так же, как делают прививку против оспы). Выяснено, что такая чужеродная ДНК никогда не встраивается в структуры клетки, но может существовать в цитоплазме клеток длительное время (недели и месяцы), что вполне достаточно для выработки иммунного ответа организма. ДНК-вакцины будет проще производить и легче транспортировать вследствие большей стабильности ДНК по сравнению с белками. Кроме того, после ДНК-вакцинации чужеродный белок будет производиться клетками самого организма и может появиться на поверхности клеток, что будет способствовать более эффективному иммунному ответу.
ГЕНОТЕРАПИЯ — новое направление медицины, но методология ее тесно
связана с ДНК-вакцинацией. Ее цель заключается в том, чтобы компенсировать
наследственные или приобретенные биохимические дефекты путем введения генов в
зрелый организм, не изменяя наследственность человека. Генно-инженерные
конструкции ДНК должны лишь заставить клетки организма вырабатывать необходимый
организму белок. В настоящее время проведены испытания на животных.
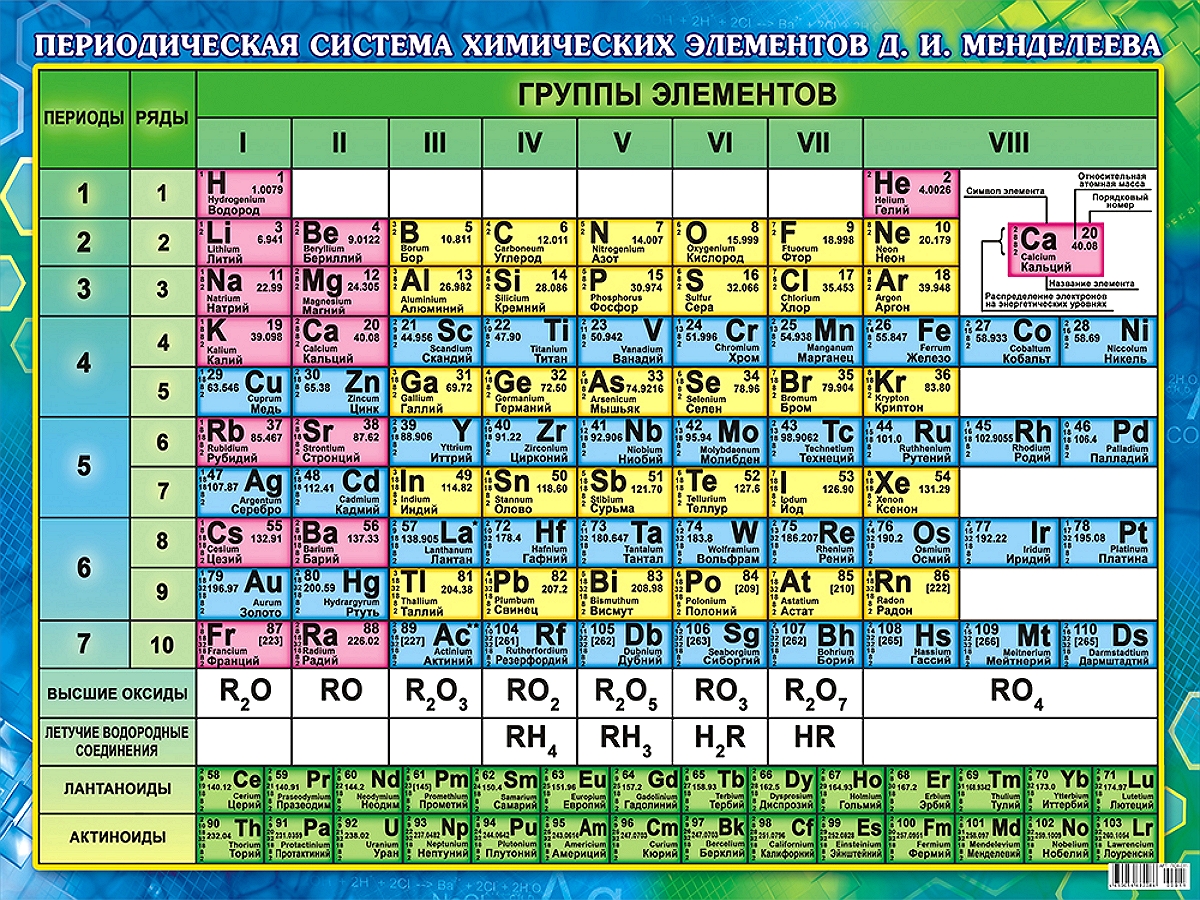
![]()
Основные классы органических соединений
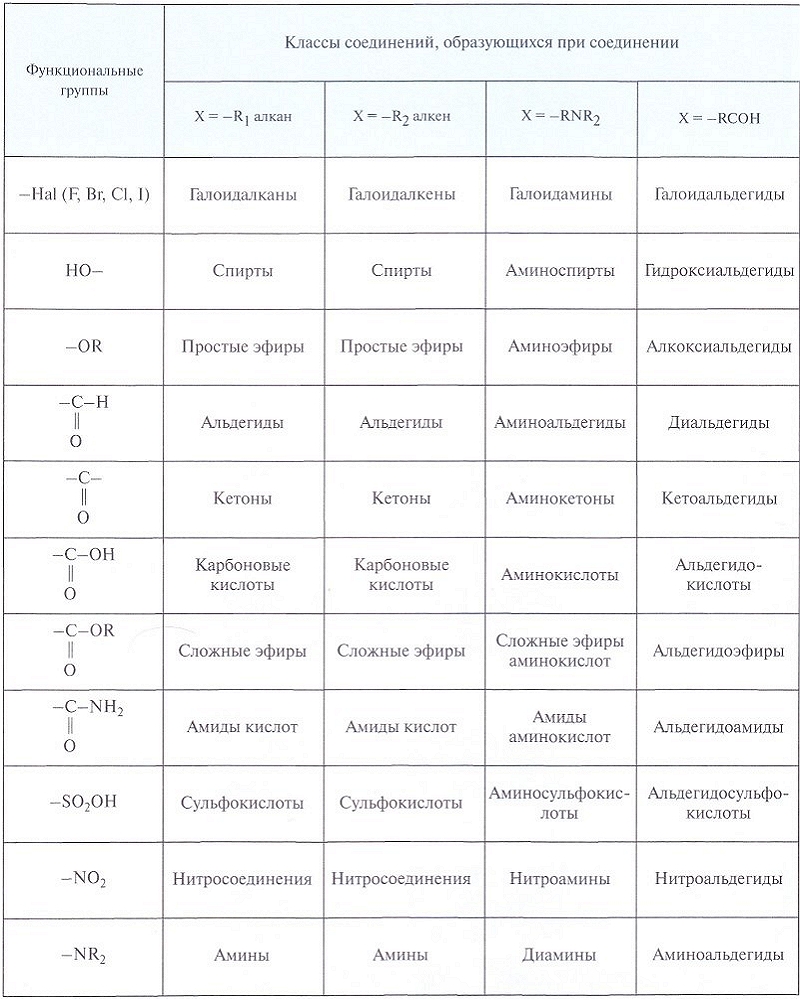 |
 |
![]()
|
Физические свойства и типы химической связи в кристаллах |
|||||||
|
Структуры и их характеристика |
Физические свойства | ||||||
|
Тип кристалла |
Вещество | Структурная единица | Основной | Температура плавления | Твердость | Электро-проводность | Растворимость |
| Молекулярные | Аг, О2, I2, Н2О, РСl3, Р4, С6H6 | Молекула | Дисперсионные силы | Низкая | Мягкие | Диэлектрики | Растворимы в неполярных растворителях |
| Ковалентные каркасные | С (алмаз), ZnS, TiО2, BaTiO3, Si, SiO2 | Атом | Ковалентная | Высокая | Твердые | Диэлектрики, полупроводники | Малорастворимые |
| Металлические | Na, Zn, Al сплавы | Атом | Металлическая | Большой диапазон | Большой диапазон, ковкие | Проводники | Растворимы в жидких металлах |
| Ионные | LiH, NaCl, Na2CO3, |Cu(NH3)4]SО4 | Ион | Ионная | Высокая | Твердые | Диэлектрики (в расплаве - проводники) | Растворимы в полярных растворителях |
![]()
|
Классификационная таблица полимеров |
||
|
Ступень деления |
Классификационная группа |
Примеры |
|
Класс |
Однородность элементного состава основной цепи макромолекулы |
Гомоцепные, гетероцепные |
|
Подкласс |
Вид химических элементов в основной цепи макромолекулы |
Полимеры с одинарными, двойными и тройными связями, ациклические макромолекулы |
|
Группа |
Характер химических связей в основной цепи макромолекулы |
Углеродоцепные (карбоцепные), кремнийцепные (полисиланы), сероцепные (полисеры) и т. д. |
|
Подгруппа |
Тип заместителей у элементов основной цепи макромолекулы |
Полиамины (карбоцепные полимеры с одинарными связями в основной цепи) полиолефина (атомы Н или алкидные группы в качестве боковых заместителей), галогеносодержащие полиамины, полифазены, полиорганофосфазены, гюлиорганофосфагены, полиорганооксифосфазены |
|
Вид |
Структурная формула составного повторяющегося звена |
Галогенсодержащие полианы (поливинилхлорид, поливинилиденхлорид, тетрафторэтилен), полиолефины (полиэтилен, полипропилен, пол и изобутан), полиамиды (полигексаметиладипамид, поли n-фенилентрифталамид и т. п.) |
![]()
| Эффективные ван-дер-ваальсовы радиусы некоторых атомов и групп | |||||
| Атом | Радиус, нм | Атом | Радиус, нм | Атом или группа | Радиус, нм |
|
Н |
12 |
S |
185 |
Вг |
195 |
|
N |
15 |
Se |
20 |
I |
215 |
|
Р |
19 |
Те |
22 |
СН3 |
20 |
|
As |
20 |
F |
135 |
СН2 |
20 |
|
О |
14 |
Сl |
18 |
Ароматическое кольцо |
17 |
![]()
|
Энергетические барьеры внутреннего вращения относительно некоторых связей |
|||
| Связь в молекуле | Энергетич. барьер, кДж/моль | Связь в молекуле | Энергетич. барьер, кДж /моль |
| СН3 - СН3 | 12,06 | СН3 - СООСН3 | 4,90 |
| СН3 - СН2 - СН3 | 13,20 | CH3 - NH2 | 8,12 |
| цис-СН3- СН = СН - СН3 | 3,12 | 4,48 | |
|
СН3 - СНО |
4,81 |
СН3 - С - СН3 ll ll О |
11,39 |
![]()
| Гетероциклические основания НК | |||
|
Положение заместителя в пиримидиновом кольце |
Название |
Нахождение |
|
|
химическое |
тривиальное |
||
|
О=С2 О=С4 Н—С5 углевод-Nl |
2,4-диоксипиримидин |
Урацил |
РНК |
|
О=С2 О=С4 Н3С-С5 углевод-Nl |
5-метил-2,4-диоксипиримидин |
Тимин |
ДНК |
|
О=С2 H2N-C4 H-C5 углевод-Nl |
2-окси-4-аминопиримидин |
Цитозин |
ДНК, РНК |
|
Положение заместителя в пуриновом кольце |
|
СН3-ОН |
|
| H2N-C2 О=C6 углевод-N9 | 2-амино-6-оксипурин | Гуанин | ДНК, РНК |
|
Н—С2 H2N—C6 углевод-N9 |
6-аминопурин |
Аденин |
ДНК, РНК |